섬모
| 섬모 | |
|---|---|
 | |
 | |
| 정보 | |
| 식별자 | |
| 라틴어 | cilium |
| 영어 | cilium |
| MeSH | D002923 |
| TH | H1.00.01.1.01014 |
| FMA | 67181 |
섬모(纖毛, cilium, pl. cilia, 라틴어: cilium→속눈썹)는 진핵세포에서 널리 보이는 세포소기관으로, 세포막이 짧은 털이나 가느다란 실처럼 돌출된 꼴로 되어 있다.[1][2] 미세소관 이중체(doublet) 아홉 가닥(9×2)이 세포체에서 뻗어 나와 축(axoneme)을 이루어 안쪽에서 지탱한다.[3] 진화적으로 대단히 강하게 보존되어 있으며, 종마다 운동·감각·발생·항상성 유지에 이르기까지 다양한 기능을 수행한다.[4]
세포마다 섬모의 수·구조·기능 따위가 다르기 때문에, 학자마다 다양하게 분류하곤 한다. 보통 운동성에 따라서는 운동성 섬모(motile cilia)와 비운동성 섬모(non-motile cilia)로 구분하고, 구조적으로는 축 한가운데에 미세소관 단일체 두 가닥이 더 있는지 여부에 따라 9+2 구조와 9+0 구조로 구분한다.[3][주해 1] 대체로 운동성 섬모는 9+2 구조, 비운동성 섬모는 9+0 구조이지만, 속귀 털세포처럼 9+2 구조이면서도 움직이지 못하는 경우가 있는가 하면[5] 배아 원시결절 세포의 결절섬모(nodal cilia)처럼 9+0 구조인데 움직이는 경우도 있으므로[6], 구조와 운동성에 따라 도합 네 가지 유형이 있는 셈이다.[3][4] 섬모의 수라는 측면에서도 운동성 섬모는 대체로 세포 하나에 여럿이 나 있는 반면 비운동성 섬모는 하나씩 나 있다는 경향이 보이지만, 역시 반례가 많다.[7] 이를테면 후각세포에는 비운동성 섬모가 수십 개씩 있다.[3] 이런 이유로 일부 학자는 섬모의 개수를 별도의 구분 기준으로 제안하기도 하였다.[7]
17세기 안토니 판 레이우엔훅은 현미경을 들여다보며 연구하다가 최초로 섬모를 관찰·기술하였는데, 아마도 운동성 섬모였던 것으로 보인다.[8] 운동성 섬모는 디네인이라는 분자 모터가 있어 미세소관 이중체 가닥끼리 이어 주기 때문에, 디네인 팔(dynein arm)이 ATP를 소모하여 힘을 생성하면 미세소관 이중체의 상대운동에 의하여 섬모가 휘어지고 펴지는 박동이 일어난다.[4] 이로써 운동성 섬모는 세포가 주변 물질과 액체의 흐름을 조절하게끔 돕는다. 예컨대 기관 상피 세포는 저마다 운동성 섬모가 200여 개씩 있어 점액을 허파로부터 밀어 올림으로써 이물질과 병원체를 제거하는데, 이를 점액 섬모 청소라고 한다.[9][10] 이 밖에도 뇌실막 세포의 운동성 섬모는 뇌실계에서 뇌척수액 순환을 추동하며, 수아강 포유류 암컷의 나팔관에 있는 운동성 섬모는 난자가 난소에서 자궁으로 이동하도록 돕는다.[11][12] 정자나 각종 원생동물 등 편모가 있어 헤엄을 치는 진핵세포도 있는데, 9+2 구조를 비롯한 분자 구성을 공유하므로 이 역시 운동성 섬모에 해당한다.[7]
동물세포 대다수는 9+0 구조의 비운동성 섬모를 하나씩 가지는데, 이를 일차섬모(primary cilium)라고 한다.[13][14][15] 일차섬모는 1898년에 발견되었지만, 한 세기 동안 대부분 무시되었고 중요한 기능이 없는 흔적 기관으로 간주되었다.[2][16] 최근 연구는 일차섬모가 화학 감각, 신호 전달 및 세포 성장 제어 등에 꼭 필요하다는 사실을 밝혀냈으며, 이에 따라 오늘날 일차섬모는 감각 기관의 역할을 하는 일종의 '세포 안테나' 내지 '감시탑' 등으로 비유되곤 한다.[17][18][19]
섬모는 갖가지 생리적·발생학적 과정에서 핵심적인 역할을 담당한다.[3] 심지어 운동성 섬모조차도 운동 기능뿐만 아니라 기계수용기 및 화학수용체 기능까지 담당한다는 사실이 밝혀졌다.[7][20] 섬모가 다양한 기능에 필요한 만큼 섬모 구조·기능 이상과 연관되어 생기는 질환 역시 대단히 다양하며, 갖가지 증세가 동시에 나타나는 다면발현적 성격이 두드러지곤 한다.[3][21][22] 다낭콩팥병[23], 선천성 심장병[24], 승모판 탈출증[25], 망막병증 등이 그 예이다.[26] 이러한 질병을 통틀어 섬모병증이라고 부른다.[21][22]
구조
[편집]미세소관 지지대: 축과 바닥소체
[편집]
(B) 섬모는 길이 방향을 따라 몇 가지 구역으로 나뉜다.
길쭉한 섬모를 안쪽에서 지탱하는 것은 미세소관 이중체로 이루어진 세포골격 구조이다. 미세소관 이중체는 온전한 A 소관, 그리고 원섬유가 적고 불완전한 B 소관이 나란히 붙은 꼴로 되어 있다. 이러한 미세소관 이중체 아홉 가닥이 섬모의 둘레를 따라 고리를 이루는 구조가 바로 축(axoneme)이다. 축은 한가운데에 미세소관 단일체 두 가닥이 더 놓여 있는지 여부에 따라 9+0 구조와 9+2 구조로 구분된다.[3]
축의 미세소관 다발이 뻗어나오는 근원은 섬모가 세포체로 이어지는 부위, 즉 섬모의 '바닥(base)'에 위치한 바닥소체(basal body)라는 구조이다. 바닥소체란 곧 변형된 중심립이다. 세포가 분열하고 있지 않을 때면 중심체가 세포 표면 쪽으로 이동하는데, 이때 모중심립(mother centriole)이 딸중심립(daughter centriole)보다 더 표면 가까이 위치하여 바닥소체를 이루어 섬모 축을 만들어내는 것이다.[3][주해 2] 섬모를 만들려면 바닥소체가 꼭 필요하다. 바닥소체 없이 섬모가 생기는 사례는 보고된 바 없다.[주해 3] 이는 다섬모세포(multiciliated cell)라도 마찬가지여서, 섬모 수만큼 바닥소체가 필요하므로 일반적인 세포와 달리 'deuterosome'이라고 하는 구조에서 무수한 중심립을 새롭게(de novo) 만들어낸다.[27][29][주해 4]
미세소관 지지대의 구조는 위치마다 조금씩 다르다. 이에 따라 섬모의 길이 방향으로 몇 가지 구역이 나뉜다.[4] 중심립은 미세소관 삼중체 아홉 가닥으로 이루어져 있다. 미세소관 삼중체란 온전한 A 소관 곁에 불완전한 B 소관이, 다시 그 곁에 불완전한 C 소관이 붙은 꼴이다.[27][주해 5] 바닥소체를 이루는 미세소관은 이행구역(transition zone)을 거쳐 축으로 뻗는다. 바닥소체의 C 소관이 끊기고 A, B 소관이 축의 A, B 소관으로 이어지면서 삼중체 구조가 이중체 구조로 이행한다.[30] 운동성 섬모의 경우, 섬모 운동을 가능하게 하는 디네인 팔을 비롯한 각종 구조가 바로 이 부위, 이중체로 된 섬모 줄기 부분에 존재한다. 한편 섬모의 끝쪽에 이르러서는 미세소관 단일체 구조가 관찰되기도 한다.[4]
섬모를 섬모답게: 이행구역과 섬모막
[편집]축에서 바닥소체에 가장 '가까운(proximal)' 부위를 이행구역이라고 부른다. 이행구역 덕택에 섬모는 하나의 독특한 구획(compartment)이 된다. 섬모는 세포체에서 뻗어 나온 구조이므로, 섬모 속 공간인 섬모내강(ciliary lumen)을 채우는 내용물은 세포질의 일부일 따름이며, 섬모를 감싸는 섬모막(ciliary membrane) 역시 세포막 일부가 돌출된 것에 지나지 않는다. 그럼에도 이행구역이 섬모와 세포체 사이 물질 수송을 적극적으로 조절하기에, 섬모내강과 섬모막은 세포질 및 세포막의 나머지 부분과 조성·기능이 상당히 다르다. 이처럼 섬모라는 구획을 지키는 문과 같은 역할을 한다는 뜻에서 이행구역을 섬모문(ciliary gate)이라고도 부른다.[30][31][32]
바닥소체가 끝나고 이행구역이 시작됨을 알리는 구조는 이행섬유(transition fibers)이다. 이행섬유는 성숙한 섬모가 완성되기 이전, 섬모형성(ciliogenesis) 과정에서부터 중요한 역할을 한다. 섬모가 만들어지려면 중심립이 세포막에 가서 결합(docking)하여야 한다. 바닥소체가 될 모중심립에는 이 과정을 돕는 구조가 달려 있는데 이것이 바로 이행섬유이다.[31] 성숙한 섬모의 구조를 보면, 바닥소체의 C 소관이 끊기는 부위에서 삼중체마다 하나씩, 도합 아홉 줄기의 이행섬유가 세포막으로 뻗어 마치 바람개비 같은 모양을 이룬다.[30] 이행섬유를 지나 축 쪽 이행구역으로 올라가면 섬모 목걸이(ciliary necklace)와 Y 연결(Y-link)이라는 특징적인 구조가 나타난다. 이행구역 세포막에는 구슬 모양의 입자들이 박혀 있는데, 둘레를 따라 배열된 모습이 마치 목걸이가 층층이 쌓인 것과도 같아 섬모 목걸이라고 명명되었다. Y 연결은 축의 미세소관 이중체 가닥을 섬모막 및 섬모 목걸이와 이어 준다.[30][31]
섬모막의 단백·지질 조성은 독특하다. 선택적 수송을 통해 섬모에서 중요한 기능을 담당하는 각종 막 단백질이 섬모막에 집중된다. 특히 여기에는 다양한 수용체와 신호전달 인자가 포함되어, 섬모가 외부 신호를 감지·전달하는 '안테나'와 같은 소기관이 되게끔 한다. 한편 지질 생합성 효소의 분포 등으로 말미암아 섬모막의 인지질·스테롤 조성 역시 세포막의 나머지 부분과 사뭇 달라진다. 섬모막 특유의 지질 조성은 섬모에 필요한 막 단백이 바른 위치에 집중되도록 돕고 각종 신호 전달에도 관여하는 것으로 보인다.[33]
잔뿌리
[편집]섬모의 세포체 쪽 끝에 바닥소체가 있고, 여기서부터 세포골격과 비슷한 구조가 섬모의 길이 방향으로 뻗는데 이를 잔뿌리(rootlet)라고 한다. 지름은 대체로 80~100nm이고, 약 55~70nm 간격으로 가로 줄무늬가 나 있다. 잔뿌리를 이루는 주요 단백은 루트레틴(rootletin)으로, CROCC 유전자가 암호화하며 코일드 코일(coiled coil) 구조로 되어 있다.[34]
기능
[편집]축은 섬모를 움직이는 내외부 디네인 팔의 지지대 역할을 하며, 키네신과 디네인의 운동 단백질을 위한 미세소관 경로를 제공한다.[2][35][36]
편모내수송
[편집]섬모 구성 요소의 수송은 축삭 수송과 유사한 편모내수송에 의해 이루어진다. 수송은 양방향이며 세포골격 운동 단백질인 키네신과 디네인이 미세소관 경로를 따라 섬모 구성 요소를 수송한다. 키네신은 섬모 끝쪽으로 순행 운동을, 디네인은 세포체 쪽으로 역행 운동을 한다. 섬모는 주변 세포막 내에 둘러싸인 자체 섬모막을 가지고 있다.[37]
운동 기능
[편집]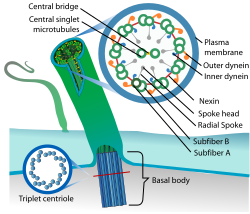
운동성 섬모의 축을 이루는 미세소관 이중체끼리는 갖가지 단백으로 이어져 있다. 먼저 넥신이라는 단백이 이웃한 이중체를 이어 준다. 또한 A 소관에는 디네인 단백이 규칙적으로 분포하여 이웃한 미세소관 이중체를 잇는 팔을 이룬다. 축의 중심 방향으로 뻗는 것도 있고 가장자리 방향으로 뻗는 것도 있으므로 각각 내부 디네인 팔(inner dynein arm, IDA), 외부 디네인 팔(outer dynein arm, ODA)이라고 부른다. 디네인 팔은 ATP를 소모하여 힘을 생성하는 분자 모터이다. IDA는 이웃한 미세소관 이중체 두 가닥으로 하여금 서로 미끄러지듯 운동하도록 힘을 준다. 그런데 미세소관 이중체끼리는 넥신으로도 서로 이어져 있기 때문에, IDA가 생성된 힘은 섬모의 굽힘 운동으로 전환된다. 한편 ODA는 박동의 속도와 주기에 영향을 미친다.[4][38]
9+2 구조로 된 운동성 섬모의 경우, A 소관의 길이 방향을 따라서 디네인 말고도 부챗살(radial spoke)이라는 구조가 규칙적으로 분포한다.[4] 다양한 단백의 복합체로 된 T자 모양 구조로, 가장자리의 미세소관 이중체를 가운데의 미세소관 단일체 쌍과 이어 준다. 부챗살은 디네인 팔이 생성한 힘을 나선운동이 아니라 평면적인 박동운동으로 전환하는 역할을 한다. 그뿐만 아니라 부챗살은 다양한 신호에 반응하여 형태를 바꿈으로써 상황에 따라 섬모의 운동 양상을 조절하는 데에 관여하는 것으로 보인다.[39]
섬모형성
[편집]섬모가 만들어지는 과정을 섬모형성(ciliogenesis)이라고 한다. 초기 단계는 바닥소체를 성장하는 섬모막에 도킹시키는 것이며, 그 후 이행구역이 형성된다. 튜불린과 같은 섬모 축의 구성 요소는 부분적으로 편모내수송에 의존하는 과정을 통해 섬모 끝에 추가된다.[40][41] 예외로는 초파리 정자와 열대열원충 편모 형성에서 섬모가 세포질에서 조립되는 경우가 있다.[42]
운동성 섬모
[편집]

운동성 섬모는 보통 세포 표면에 대량으로 존재하며(다섬모), 이시성 박동으로 조정된 파동을 일으킨다.[43] 다섬모 세포는 호흡계에 분포하며 점액 섬모 청소에서 기능하여 허파로부터 이물질을 함유한 점액을 쓸어낸다.[11] 호흡상피의 각 세포에는 약 200개의 운동성 섬모가 있다.[9]
생식기에서는 민무늬근육 수축이 섬모의 박동을 도와 난자를 난소에서 자궁으로 이동시킨다.[11][12] 뇌실계의 뇌실에서 섬모 뇌실막 세포는 뇌척수액을 순환시킨다.
운동성 섬모의 기능은 섬모를 둘러싼 주변 섬모액층의 최적 수준을 유지하는 데 크게 의존한다. 상피 세포 나트륨 통로(ENaC)는 호흡기 계통과 나팔관 또는 난관의 섬모 전체 길이에 걸쳐 특이적으로 발현되며, 이는 주변 섬모액을 조절하는 센서 역할을 하는 것으로 보인다.[11][44]
운동성, 다중, 9+0 섬모는 맥락얼기의 상피 세포에서 발견된다. 섬모는 또한 고온에 노출되면 구조가 변하여 날카로워질 수 있다. 각 세포에 많은 수로 존재하며 상대적으로 느리게 움직이므로 운동성 섬모와 일차섬모 사이의 중간적이다.[7]
운동성 섬모와 편모
[편집]정자와 많은 원생동물에 있는 운동성 섬모는 액체 속을 헤엄칠 수 있게 하며 전통적으로 "편모"라고 불린다.[45] 이러한 돌출부가 운동성 섬모와 구조적으로 동일하기 때문에, 이 용어를 보존하려는 시도는 형태학적 구별("편모"는 일반적으로 일반 섬모보다 길고 다른 물결 모양의 움직임을 가짐)[46], 및 수[47]를 통해 이루어진다.
미생물의 운동성 섬모
[편집]섬모충류는 운동성 섬모만을 가지고 이동이나 액체를 표면 위로 이동시키는 데 사용하는 진핵생물 미생물이다. 예를 들어, 짚신벌레는 수천 개의 섬모로 덮여 있어 헤엄칠 수 있다. 이 운동성 섬모는 감각 기능도 하는 것으로 밝혀졌다.[48]
일차섬모
[편집]거의 모든 동물 세포에는 비운동성 섬모가 하나씩 있다. 혈액 세포가 주목할 만한 예외이다.[2] 운동성 섬모를 가진 세포와는 대조적이다. 망막 시각 세포와 같은 일부 세포 유형은 고도로 특수화된 일차섬모를 가지고 있다.[49]
일차섬모는 G1기 동안 조립되고 체세포 분열이 발생하기 전에 분해된다.[50][14] 섬모의 분해는 오로라 키나제 A의 작용을 필요로 한다.[51] 일차섬모에 대한 현재의 과학적 이해는 일차섬모를 "많은 세포 신호 전달 경로를 조율하고, 때로는 신호 전달을 섬모 운동성 또는 세포 분열 및 분화와 연결시키는 감각 세포 안테나"로 본다.[52] 이러한 섬모를 통한 신호 전달 중 일부는 헤지호그 신호 전달과 같은 리간드 결합을 통해 발생한다.[17] 다른 형태의 신호 전달에는 뉴런의 소마토스타틴 수용체 3를 포함한 G 단백질 연결 수용체가 있다.[53]
상피 조직 세포에 있는 일차섬모는 일종의 '세포 안테나'로 세포외 환경의 화학수용기, 온도수용기, 기계수용기 역할을 한다.[13][54] 이 섬모는 외부 세포 환경의 가용성 인자, 유체 흐름의 하류에서 영향을 미치는 가용성 단백질이 방출되는 분비 역할, 그리고 운동성 섬모의 경우 유체 흐름의 매개를 포함하여 특정 신호 전달을 중재하는 역할을 한다.[54]
일부 상피세포는 섬모를 가지고 있으며, 일반적으로 섬모가 내강으로 돌출된 극성 세포의 판으로 존재하여 관 또는 세관을 형성한다. 이러한 감각 및 신호 전달 역할은 섬모를 국소 세포 환경 유지에 중요한 역할로 만든다.[22]
속귀 털세포
[편집]속귀 털세포를 비롯한 일부 조직에는 이른바 '고정섬모(stereocilia, 그리스어: στερεός →단단함, 확고함)' 또는 '부동섬모'라는 구조가 있어 혼동을 준다.[주해 6] 미세소관으로 이루어진 섬모와 달리, 속귀의 '고정섬모'는 액틴 미세섬유로 이루어져 있다.[5] 따라서 섬모보다는 오히려 미세융모 및 사상족과 같은 분류로 묶인다.[55] 이 때문에 '고정융모(stereovilli)'라는 이름을 선호하는 학자도 있다.[3]
한편 속귀 털세포에는 또 '운동섬모(kinocilium, 라틴어: kino- →움직임)'라는 구조가 있는데, 통상적인 운동성 섬모처럼 9+2 구조로 되어 있다고 알려졌기에 이와 같이 명명되었다.[56] 하지만 실제로는 이름과는 달리 특수한 일차섬모에 해당한다. 내부 디네인 팔이 없으므로 자발적으로 움직이지 못하는 것이다. 다만 외부 디네인 팔이 있어 소리 진동에 의해 수동적으로 움직일 따름이다.[5]
축삭 섬모 시냅스
[편집]축삭 섬모 시냅스(axo-ciliary synapse)는 세로토닌성 축삭돌기와 CA1 피라미드 세포 신경 세포의 일차섬모가 소통하는 것을 이르는 말로, 신경 세포의 세포핵에서 후성유전 상태를 변화시킨다. 이는 세포막에서의 신호 전달과는 다른, 더 장기적인 방식으로 "핵에서 전사되거나 만들어지는 것을 변화시키는 방법"이다.[57][58]
결절섬모
[편집]
배아 발생 초기에 나타나는 구조인 원시결절을 이루는 세포들은 9+0 구조의 운동성 섬모를 하나씩 갖는다.[6] 가운데의 미세소관 쌍 및 부챗살이 없으므로, 디네인 팔의 움직임은 평면상의 박동운동이 아니라 회전운동으로 전환된다. 이로써 배아외액이 원시결절을 왼쪽 방향으로 가로질러 흐르게 되는데, 이 흐름이 바로 배아의 좌우 비대칭을 만드는 근원이 된다.[9][59]
원시결절에는 서로 다른 유형의 결절섬모를 가진 두 영역이 있다. 중앙 마디에는 운동성 섬모가 있고, 마디의 주변 영역에는 변형된 운동성 결절섬모가 있다.[59] 중앙 섬모는 회전 박동을 조율하고, 측면의 비운동성 섬모는 흐름의 방향을 감지한다.[59][60][61] 쥐 연구에 따르면 흐름 방향이 감지되는 생물물리학적 메커니즘이 존재한다.[62]
임상적 중요성
[편집]섬모 결함은 여러 인간 질병을 유발하는데, 이를 통틀어 섬모병증(ciliopathy)이라고 한다.[22][63] 알려진 섬모병증에는 다낭성 간 질환, 알스트룀 증후군, 메켈-그루버 증후군, 젠젠브레너 증후군 및 일부 형태의 망막병증이 포함된다.[21][54] 섬모 기능을 저해하는 유전 변이는 원발성 섬모 이상운동증(PCD), 콩팥황폐증 및 시니어-뢰켄 증후군과 같은 만성 질환을 유발할 수 있다. 또한, 콩팥세관 세포의 일차섬모 결함은 다낭콩팥병(PKD)을 유발할 수 있다. 바르데-비들 증후군(BBS)이라는 또 다른 유전 질환은 바닥소체 및 섬모를 이루는 구조 단백에 영향을 미치는 돌연변이 때문에 생긴다.[21]
섬모 기능 장애로 인한 다양한 결과는 섬모 기능에 다양한 방식이나 정도로 손상을 입히는 다양한 강도의 대립유전자에서 비롯될 수 있다. 많은 섬모병증은 멘델식으로 유전되지만, 이행구역 및 BBS 복합체와 같은 상이한 기능성 섬모 복합체 간의 특정 유전적 상호작용은 열성 섬모병증의 표현형 발현을 변경할 수 있다.[64][65] 이행구역 단백질의 일부 돌연변이는 특정 심각한 섬모병증을 유발할 수 있다.[66]
섬모 길이를 따라 발현되는 상피 세포 나트륨 통로(ENaC)는 주변 섬모액층 수준을 조절한다. 돌연변이로 ENaC 활성이 감소하면 다계통성 가성 알도스테론증을 유발하며, 이는 불임 문제와 관련이 있다.[11] 한편 낭포성 섬유증은 돌연변이로 염화 이온 통로인 CFTR 기능에 문제가 생겨서 나타나는 병인데, 이때에는 반대로 ENaC 활성이 너무 증가하기 때문에 액체 수준이 심각하게 감소하여 호흡기 합병증 및 감염을 유발한다.[44]
운동 기능 이상
[편집]원발성 섬모 이상운동증(primary ciliary dyskinesia, PCD)은 운동성 섬모에 이상이 생기는 유전성 섬모병증을 일컫는다. 운동성 섬모 발생·구조·기능에 영향을 미치는 유전 변이라면 무엇이든 PCD의 원인이 될 수 있다. 주된 임상양상은 좌우 비대칭성 이상, 불임, 만성적인 흐흡기 감염 등이다.[9] 점액 섬모 청소 기능에 문제가 있으므로 점액과 병원체가 제거되지 않고 쌓이며, 이에 따라 기침·축농증 및 호흡기 감염이 그치지 않는다.[10]
포유류 몸이 좌우가 비대칭인 모양으로 정상 발생하려면 섬모 기능이 꼭 필요하기에[67], PCD 환자의 약 50%에서 좌우 비대칭성 이상이 관찰된다.[9][10] PCD는 내장 역위증(일련의 증상이 카르타게너 증후군으로 알려져 있음) 및 내장 기형증과 같은 좌우 해부학적 이상과 관련이 있다.[68] 이러한 좌우 해부학적 이상은 또한 선천성 심장병을 유발할 수 있다.[69]
PCD에서 난임이 얼마나 흔한지는 분명하지 않으나, 한 연구에서는 여성의 61%, 남성의 83%에서 난임이 나타난다고 집계하였다. 섬모 운동 기능 장애는 다양한 경로로 생식 능력에 영향을 미칠 수 있다고 예상된다. 여성의 경우, 나팔관 상피세포의 섬모가 난자 및 배아를 운송하는 데에 관여하며, PCD 여성에서 나팔관 섬모 운동 기능이 저하된 사례가 보고되었으므로, 이러한 과정의 문제로 말미암아 여성 난임이 나타나리라고 추론할 수 있다. 하지만 아직까지 실제 난임 PCD 여성에서 섬모 기능 저하가 확증된 바는 없다.[70] 한편 나팔관 섬모 기능이 정상이어야 배아가 자궁에 제대로 착상할 터이므로, 섬모 운동 장애가 자궁외임신을 유발하리라는 추측도 있었다.[12][71] 하지만 PCD 여성에서 자궁외임신 빈도가 더 높다는 증거는 없다.[70] 남성에서는 정자 운동성 장애가 흔히 관찰되는데, 운동성 섬모의 일종인 편모 기능이 저하되었기 때문이라고 설명할 수 있다. 또 고환날세관 섬모 기능에 이상이 있으면 정자가 세관에서 응집(agglutination)한다고 알려져 있는데, 이 역시 정자 생존력·운동성에 영향을 미칠 가능성이 있다.[70]
일차섬모 기능 이상
[편집]오늘날 일차섬모가 많은 인간 장기 기능에 중요한 역할을 한다는 사실이 밝혀졌다.[2][13] 예컨대 이자에는 고도로 분화된 외분비 세포와 내분비 세포가 섞여 있는데, 일차섬모는 중심선 세관 세포인 외분비 세포에 존재한다.[72][73] 한편 내분비 조직을 이루는 다양한 호르몬 분비 세포 가운데 인슐린 분비를 담당하는 베타 세포와 글루카곤 분비를 담당하는 알파 세포는 고도로 섬모화되어 있다.[74][75] 이들 세포의 일차섬모는 에너지 대사를 비롯한 기능을 조절하기 때문에, 섬모 결함이 있으면 이자 세관 기능 장애 및 제2형 당뇨병으로 이어질 수 있다.[73] 섬모 세포의 결함은 비만과 관련이 있으며 종종 제2형 당뇨병에서 두드러진다. 여러 연구에서 섬모병증 모델에서 포도당 내성 감소 및 인슐린 분비 감소가 이미 나타났다. 또한, 제2형 당뇨병 모델에서 섬모의 수와 길이가 감소했다.[76]
섬모 기능에 영향을 미치는 요인
[편집]섬모 기능의 감소는 감염으로도 발생할 수 있다. 미생물막에 대한 연구는 박테리아가 섬모를 변화시킬 수 있음을 보여주었다. 미생물막은 동일하거나 여러 종의 박테리아로 구성된 박테리아 공동체이다. 세포 집단은 세포외 기질을 형성하는 다양한 인자를 분비한다. 호흡기 계통의 섬모는 점액과 병원균을 기도 밖으로 이동시키는 것으로 알려져 있다. 미생물막 양성 감염 환자들은 섬모 기능이 손상된 것으로 밝혀졌다. 이러한 손상은 운동성 감소 또는 섬모 수 감소로 나타날 수 있다. 이러한 변화는 외부 원인에서 비롯되지만, 박테리아의 병원성, 감염 진행, 치료 방식에 여전히 영향을 미친다.[77]
흡연(염증 유발) 및 감염은 섬모 수를 감소시킬 수 있으며, 섬모 박동은 호르몬 변화에 의해 영향을 받을 수 있다.[12][71]
역사
[편집]| “ | 나는 또한 둘째 종류의 극미동물을 발견하였는데 (···) 배는 납작했고, 몹시 가늘고 작은 다리 혹은 발이 여럿 달렸는데, 매우 날쌔게 놀렸으며 (···) 이로써 무척 빠르게 움직였습니다. | ” |
섬모를 처음 관찰한 학자는 1674~5년경 안토니 판 레이우엔훅이었던 것으로 보인다.[8][45] 섬모·편모라는 이름이 쓰이기 시작한 것은 훨씬 나중이었다. 섬모(라틴어: cilium→속눈썹)는 1786년 덴마크의 오토 프리드리히 뮐러(덴마크어: Otto Friedrich Müller)가, 편모(라틴어: flagellum→채찍)는 1841년 프랑스의 펠릭스 듀자르댕(프랑스어: Félix Dujardin)이 처음 사용했던 것으로 보인다. 19세기 중반에 이르러 세포에 하나만 (혹은 몇 개만) 있으면 편모, 여러 개 있으면 섬모라고 부른다는 쓰임새가 굳어졌다.[8]
19세기 말 중심체·중심립이 처음 발견되고 활발하게 연구되던 맥락에서, 독일의 테오도르 빌헬름 엥겔만(독일어: Theodor WIlhelm Engelmann)은 바닥소체를 처음 관찰하고 1880년 '바닥소체(basal body, 독일어: Basalkörper)'라고 명명하였다. 1898년 카를 빌헬름 치머만(독일어: Karl Wilhelm Zimmerman)은 운동성 섬모가 다수 있는 세포와 달리, 섬모가 하나만 있는 세포에서는 섬모와 중심체가 가까이 붙어 있곤 한다는 사실을 관찰했다. 당시 중심체가 세포분열과 밀접하게 연관되었음이 이미 알려져 있었기 때문에, 자연스럽게 섬모 역시 세포주기와 긴밀히 얽혀 있으리라는 결론이 도출되었다.[8]
편모가 박동하는 원리에 대해서는 19세기부터 다양한 이론이 제안되었다. 1868년 엥겔만은 편모 한가운데에 가는 섬유 가닥(fibril)들이 있어 수축함으로써 박동이 일어나는 것이라고 주장했다. 투과전자현미경의 발명으로 섬모·편모 내부에 섬유와 같은 구조가 존재한다는 사실이 비로소 확증되었다. 1954년 최초로 섬모의 초미세구조(ultrastructure)를 관찰한 연구가 출판되었다.[45]
같이 보기
[편집]각주
[편집]내용주
[편집]- ↑ 단일체인지 이중체인지까지 밝히려면 각각 9×2 + 2×1, 그리고 9×2 + 0×1 구조라고 적어야 할 것이다.
- ↑ 대부분의 세포는 분열하고 있지 않을 때 중심립 2개로 이루어진 중심체가 하나씩 있다. 분열 시 각 중심립을 주형(template)으로 하여 새 중심립이 만들어지고, 모세포에게서 물려받은 중심립과 그것을 주형으로 하여 만들어진 중심립이 짝지어 새로운 중심체가 된다. 이를 각각 모중심립, 딸중심립이라고 부른다. 척추동물에서는 모중심립만이 바닥소체가 될 수 있으므로 (후술한 다섬모세포의 경우가 아닌 한) 세포마다 섬모를 하나씩밖에 만들 수 없다. 반면 클라미도모나스는 딸중심립도 바닥소체를 만들기 때문에 편모가 두 개씩 자란다.[27]
- ↑ 단, 섬모가 처음 만들어지는 섬모형성 단계를 지나 섬모의 성장·유지 단계에 이르면 바닥소체의 필요성은 약화한다. 성숙한 예쁜꼬마선충의 신경 세포는 바닥소체의 일부 구조가 퇴화하여 없다.[28]
- ↑ 중심립이라는 용어가 세포주기와 긴밀하게 연관되어 쓰이곤 하기에, 다섬모형성(multiciliogenesis) 과정을 기술하는 용어에도 다소간 혼란이 있다. 예컨대 일부 학자는 '중심립 없이 일어나는 바닥소체 생합성(acentriolar basal body biogenesis)'이라는 말을 쓰기도 한다.[29]
- ↑ 척추동물을 비롯한 대부분의 진핵생물에 들어맞는 설명이지만, 예쁜꼬마선충·노랑초파리 등 예외도 있다.
- ↑ 같은 그리스어 접두사가 '삼차원적', '입체'와 같은 뜻으로도 쓰이곤 하기에 간혹 '입체섬모'라고 옮기기도 한다.
참조주
[편집]- ↑ “Definition of CILIUM” (영어). 《www.merriam-webster.com》. 2022년 4월 15일에 확인함.
- ↑ 가 나 다 라 마 Gardiner, Mary Beth (September 2005). “The Importance of Being Cilia” (PDF). 《HHMI Bulletin》 18 (2). 2008년 7월 26일에 확인함.
- ↑ 가 나 다 라 마 바 사 아 자 Falk, N; Lösl, M; Schröder, N; Gießl, A (2015년 9월 11일). “Specialized Cilia in Mammalian Sensory Systems”. 《Cells》 4 (3): 500–19. doi:10.3390/cells4030500. PMC 4588048. PMID 26378583.
- ↑ 가 나 다 라 마 바 사 Fisch, C; Dupuis-Williams, P (June 2011). “Ultrastructure of cilia and flagella - back to the future!”. 《Biology of the Cell》 103 (6): 249–70. doi:10.1042/BC20100139. PMID 21728999. S2CID 7636387.
- ↑ 가 나 다 Wang, D; Zhou, J (2021). “The Kinocilia of Cochlear Hair Cells: Structures, Functions, and Diseases.”. 《Frontiers in Cell and Developmental Biology》 9: 715037. doi:10.3389/fcell.2021.715037. PMC 8374625. PMID 34422834.
- ↑ 가 나 Desgrange, A; Le Garrec, JF; Meilhac, SM (2018년 11월 22일). “Left-right asymmetry in heart development and disease: forming the right loop” (PDF). 《Development》 145 (22). doi:10.1242/dev.162776. PMID 30467108. S2CID 53719458. 2022년 10월 9일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ 가 나 다 라 마 Takeda, Sen; Narita, Keishi (February 2012). “Structure and function of vertebrate cilia, towards a new taxonomy”. 《Differentiation》 83 (2): S4–S11. doi:10.1016/j.diff.2011.11.002. PMID 22118931.
- ↑ 가 나 다 라 Bloodgood, Robert A. (2009). “From Central to Rudimentary to Primary: The History of an Underappreciated Organelle Whose Time Has Come.The Primary Cilium”. 《Methods in Cell Biology》 94: 2-52. doi:10.1016/S0091-679X(08)94001-2. PMID 20362083. 2025년 9월 6일에 확인함.
- ↑ 가 나 다 라 마 Horani, A; Ferkol, T (May 2018). “Advances in the Genetics of Primary Ciliary Dyskinesia”. 《Chest》 154 (3): 645–652. doi:10.1016/j.chest.2018.05.007. PMC 6130327. PMID 29800551.
- ↑ 가 나 다 Bustamante-Marin, Ximena M.; Ostrowski, Lawrence E. (2017년 4월). “Cilia and Mucociliary Clearance”. 《Cold Spring Harbor Perspectives in Biology》 9 (4): a028241. doi:10.1101/cshperspect.a028241. PMID 27864314.
- ↑ 가 나 다 라 마 Enuka Y, Hanukoglu I, Edelheit O, Vaknine H, Hanukoglu A (March 2012). “Epithelial sodium channels (ENaC) are uniformly distributed on motile cilia in the oviduct and the respiratory airways”. 《Histochemistry and Cell Biology》 137 (3): 339–53. doi:10.1007/s00418-011-0904-1. PMID 22207244. S2CID 15178940.
- ↑ 가 나 다 라 Panelli, DM; Phillips, CH; Brady, PC (2015). “Incidence, diagnosis and management of tubal and nontubal ectopic pregnancies: a review.”. 《Fertility Research and Practice》 1: 15. doi:10.1186/s40738-015-0008-z. PMC 5424401. PMID 28620520.
- ↑ 가 나 다 Singla, Veena; Reiter, Jeremy F. (2006년 8월 4일). “The primary cilium as the cell's antenna: signaling at a sensory organelle”. 《Science》 313 (5787): 629–633. Bibcode:2006Sci...313..629S. doi:10.1126/science.1124534. ISSN 1095-9203. PMID 16888132. S2CID 29885142.
- ↑ 가 나 Patel, MM; Tsiokas, L (2021년 11월 1일). “Insights into the Regulation of Ciliary Disassembly”. 《Cells》 10 (11): 2977. doi:10.3390/cells10112977. PMC 8616418. PMID 34831200.
- ↑ Wheatley, DN (September 2021). “Primary cilia: turning points in establishing their ubiquity, sensory role and the pathological consequences of dysfunction”. 《Journal of Cell Communication and Signaling》 15 (3): 291–297. doi:10.1007/s12079-021-00615-5. PMC 8222448. PMID 33970456.
- ↑ Satir, Peter (2017). “CILIA: before and after”. 《Cilia》 6. doi:10.1186/s13630-017-0046-8. ISSN 2046-2530. PMC 5343305. PMID 28293419.
- ↑ 가 나 Wong, Sunny Y.; Reiter, Jeremy F. (2008). “The primary cilium at the crossroads of mammalian hedgehog signaling”. 《Current Topics in Developmental Biology》 85: 225–260. doi:10.1016/S0070-2153(08)00809-0. ISSN 0070-2153. PMC 2653622. PMID 19147008.
- ↑ Prevo, B; Scholey, JM; Peterman, EJG (September 2017). “Intraflagellar transport: mechanisms of motor action, cooperation, and cargo delivery”. 《The FEBS Journal》 284 (18): 2905–2931. doi:10.1111/febs.14068. PMC 5603355. PMID 28342295.
- ↑ Elliott, Kelsey H.; Brugmann, Samantha A. (2019년 3월 1일). “Sending mixed signals: Cilia-dependent signaling during development and disease”. 《Developmental Biology》 447 (1): 28–41. doi:10.1016/j.ydbio.2018.03.007. ISSN 1095-564X. PMC 6136992. PMID 29548942.
- ↑ Bloodgood, RA (2010년 2월 15일). “Sensory reception is an attribute of both primary cilia and motile cilia”. 《Journal of Cell Science》 123 (Pt 4): 505–9. doi:10.1242/jcs.066308. PMID 20144998. S2CID 207165576.
- ↑ 가 나 다 라 Badano JL, Mitsuma N, Beales PL, Katsanis N (2006). “The ciliopathies: an emerging class of human genetic disorders”. 《Annual Review of Genomics and Human Genetics》 7: 125–48. doi:10.1146/annurev.genom.7.080505.115610. PMID 16722803.
- ↑ 가 나 다 라 Reiter, Jeremy F.; Leroux, Michel R. (September 2017). “Genes and molecular pathways underpinning ciliopathies”. 《Nature Reviews. Molecular Cell Biology》 18 (9): 533–547. doi:10.1038/nrm.2017.60. ISSN 1471-0080. PMC 5851292. PMID 28698599.
- ↑ Wagner CA (2008). “News from the cyst: insights into polycystic kidney disease”. 《Journal of Nephrology》 21 (1): 14–16. PMID 18264930.
- ↑ Brueckner M (June 2007). “Heterotaxia, congenital heart disease, and primary ciliary dyskinesia”. 《Circulation》 115 (22): 2793–95. doi:10.1161/CIRCULATIONAHA.107.699256. PMID 17548739. S2CID 14405881.
- ↑ Toomer KA 외 (2019). “Primary cilia defects causing mitral valve prolapse”. 《Sci. Transl. Med.》 11 (493): eaax0290. doi:10.1126/scitranslmed.aax0290. PMC 7331025. PMID 31118289.
- ↑ Chen, Holly Y.; Kelley, Ryan A.; Li, Tiansen; Swaroop, Anand (2020년 7월 31일). “Primary cilia biogenesis and associated retinal ciliopathies”. 《Seminars in Cell & Developmental Biology》 110: 70–88. doi:10.1016/j.semcdb.2020.07.013. ISSN 1096-3634. PMC 7855621. PMID 32747192.
- ↑ 가 나 다 Marshall, Wallace F. (2008). “Chapter 1 Basal Bodies”. 《Current Topics in Developmental Biology》 85: 1-22. doi:10.1016/S0070-2153(08)00801-6. 2025년 9월 7일에 확인함.
- ↑ Nechipurenko, Inna V.; Sengupta, Piali (2017년 12월). “The rise and fall of basal bodies in the nematode Caenorhabditis elegans”. 《Cilia》 6 (1): 9. doi:10.1186/s13630-017-0053-9. PMID 28770089.
- ↑ 가 나 Brooks, Eric R.; Wallingford, John B. (2014년 10월). “Multiciliated Cells”. 《Current Biology》 24 (19): R973-R982. doi:10.1016/j.cub.2014.08.047. PMID 25291643.
- ↑ 가 나 다 라 Szymanska, Katarzyna; Johnson, Colin A. (2012년 12월). “The transition zone: an essential functional compartment of cilia”. 《Cilia》 1 (1): 10. doi:10.1186/2046-2530-1-10. PMID 23352055.
- ↑ 가 나 다 Garcia-Gonzalo, Francesc R.; Reiter, Jeremy F. (2017년 2월 1일). “Open Sesame: How Transition Fibers and the Transition Zone Control Ciliary Composition”. 《Cold Spring Harbor Perspectives in Biology》 9 (2): a028134. doi:10.1101/cshperspect.a028134. ISSN 1943-0264. PMC 5287074. PMID 27770015.
- ↑ Gonçalves, João; Pelletier, Laurence (April 2017). “The Ciliary Transition Zone: Finding the Pieces and Assembling the Gate”. 《Molecules and Cells》 40 (4): 243–253. doi:10.14348/molcells.2017.0054. ISSN 0219-1032. PMC 5424270. PMID 28401750.
- ↑ Garcia, Galo; Raleigh, David R.; Reiter, Jeremy F. (2018년 4월 23일). “How the Ciliary Membrane Is Organized Inside-Out to Communicate Outside-In”. 《Current Biology》 28 (8): R421–R434. Bibcode:2018CBio...28.R421G. doi:10.1016/j.cub.2018.03.010. ISSN 1879-0445. PMC 6434934. PMID 29689227.
- ↑ “Rootelin”. 2022년 3월 28일에 확인함.
- ↑ Rosenbaum JL, Witman GB (November 2002). “Intraflagellar transport”. 《Nature Reviews. Molecular Cell Biology》 3 (11): 813–25. doi:10.1038/nrm952. PMID 12415299. S2CID 12130216.
- ↑ Scholey JM (January 2008). “Intraflagellar transport motors in cilia: moving along the cell's antenna”. 《The Journal of Cell Biology》 180 (1): 23–29. doi:10.1083/jcb.200709133. PMC 2213603. PMID 18180368.
- ↑ Rohatgi R, Snell WJ (August 2010). “The ciliary membrane”. 《Current Opinion in Cell Biology》 22 (4): 541–46. doi:10.1016/j.ceb.2010.03.010. PMC 2910237. PMID 20399632.
- ↑ King, SM (2016년 11월 1일). “Axonemal Dynein Arms.”. 《Cold Spring Harbor Perspectives in Biology》 8 (11): a028100. doi:10.1101/cshperspect.a028100. PMC 5088525. PMID 27527589.
- ↑ Zhu, Xiaoyan; Liu, Yi; Yang, Pinfen (2017년 5월). “Radial Spokes—A Snapshot of the Motility Regulation, Assembly, and Evolution of Cilia and Flagella”. 《Cold Spring Harbor Perspectives in Biology》 9 (5): a028126. doi:10.1101/cshperspect.a028126. PMID 27940518. 2025년 9월 7일에 확인함.
- ↑ Johnson KA, Rosenbaum JL (December 1992). “Polarity of flagellar assembly in Chlamydomonas”. 《The Journal of Cell Biology》 119 (6): 1605–11. doi:10.1083/jcb.119.6.1605. PMC 2289744. PMID 1281816.
- ↑ Hao L, Thein M, Brust-Mascher I, Civelekoglu-Scholey G, Lu Y, Acar S, Prevo B, Shaham S, Scholey JM (June 2011). “Intraflagellar transport delivers tubulin isotypes to sensory cilium middle and distal segments”. 《Nature Cell Biology》 13 (7): 790–98. doi:10.1038/ncb2268. PMC 3129367. PMID 21642982.
- ↑ Of cilia and silliness (more on Behe) – The Panda's Thumb 보관됨 17 10월 2007 - 웨이백 머신
- ↑ Benjamin Lewin (2007). 《Cells》. Jones & Bartlett Learning. 359쪽. ISBN 978-0-7637-3905-8.
- ↑ 가 나 Hanukoglu I, Hanukoglu A (April 2016). “Epithelial sodium channel (ENaC) family: Phylogeny, structure-function, tissue distribution, and associated inherited diseases”. 《Gene》 579 (2): 95–132. doi:10.1016/j.gene.2015.12.061. PMC 4756657. PMID 26772908.
- ↑ 가 나 다 Haimo LT, Rosenbaum JL (December 1981). “Cilia, flagella, and microtubules”. 《The Journal of Cell Biology》 91 (3 Pt 2): 125s–130s. doi:10.1083/jcb.91.3.125s. PMC 2112827. PMID 6459327.
- ↑ Alberts, Bruce (2015). 《Molecular biology of the cell》 6판. New York, NY. 941–942쪽. ISBN 9780815344643.
- ↑ Lindemann, CB; Lesich, KA (2010년 2월 15일). “Flagellar and ciliary beating: the proven and the possible.”. 《Journal of Cell Science》 123 (Pt 4): 519–28. doi:10.1242/jcs.051326. PMID 20145000. S2CID 18673550.
- ↑ Valentine, M; Van Houten, J (2021년 9월 24일). “Using Paramecium as a Model for Ciliopathies.”. 《Genes》 12 (10): 1493. doi:10.3390/genes12101493. PMC 8535419. PMID 34680887.
- ↑ Wolfrum, U; Schmitt, A (June 2000). “Rhodopsin transport in the membrane of the connecting cilium of mammalian photoreceptor cells.”. 《Cell Motility and the Cytoskeleton》 46 (2): 95–107. doi:10.1002/1097-0169(200006)46:2<95::AID-CM2>3.0.CO;2-Q. PMID 10891855.
- ↑ Pan J, Snell W (June 2007). “The primary cilium: keeper of the key to cell division”. 《Cell》 129 (7): 1255–57. doi:10.1016/j.cell.2007.06.018. PMID 17604715. S2CID 17712155.
- ↑ Pugacheva EN, Jablonski SA, Hartman TR, Henske EP, Golemis EA (June 2007). “HEF1-dependent Aurora A activation induces disassembly of the primary cilium”. 《Cell》 129 (7): 1351–63. doi:10.1016/j.cell.2007.04.035. PMC 2504417. PMID 17604723.
- ↑ Satir P, Christensen ST (June 2008). “Structure and function of mammalian cilia”. 《Histochemistry and Cell Biology》 129 (6): 687–93. doi:10.1007/s00418-008-0416-9. PMC 2386530. PMID 18365235.
- ↑ Wheway G, Nazlamova L, Hancock JT (2018). “Signaling through the Primary Cilium”. 《Frontiers in Cell and Developmental Biology》 6: 8. doi:10.3389/fcell.2018.00008. PMC 5809511. PMID 29473038.
- ↑ 가 나 다 Adams M, Smith UM, Logan CV, Johnson CA (May 2008). “Recent advances in the molecular pathology, cell biology and genetics of ciliopathies”. 《Journal of Medical Genetics》 45 (5): 257–67. doi:10.1136/jmg.2007.054999. PMID 18178628.
- ↑ Houdusse, Anne; Titus, Margaret A. (2021년 5월). “The many roles of myosins in filopodia, microvilli and stereocilia”. 《Current Biology》 31 (10): R586-R602. doi:10.1016/j.cub.2021.04.005. 2025년 9월 6일에 확인함.
- ↑ Sobkowicz, H. M.; Slapnick, S. M.; August, B. K. (1995년 9월). “The kinocilium of auditory hair cells and evidence for its morphogenetic role during the regeneration of stereocilia and cuticular plates”. 《Journal of Neurocytology》 24 (9): 633-653. doi:10.1007/BF01179815. 2025년 9월 6일에 확인함.
- ↑ Tamim, Baba (2022년 9월 4일). “New discovery: Synapse hiding in the mice brain may advance our understanding of neuronal communication”. 《interestingengineering.com》. 2022년 10월 19일에 확인함.
- ↑ Sheu, Shu-Hsien; Upadhyayula, Srigokul; Dupuy, Vincent; Pang, Song; Deng, Fei; Wan, Jinxia; Walpita, Deepika; Pasolli, H. Amalia; Houser, Justin; Silvia; Sebastian E.; Sambashiva; Melanie; C. Shan; Tom; Harald F.; Luke; Yulong; Séverine; David E. (2022년 9월 1일). “A serotonergic axon-cilium synapse drives nuclear signaling to alter chromatin accessibility” (영어). 《Cell》 185 (18): 3390–3407.e18. doi:10.1016/j.cell.2022.07.026. ISSN 0092-8674. PMC 9789380. PMID 36055200. S2CID 251958800.
- University press release: “Scientists discover new kind of synapse in neurons' tiny hairs” (영어). 《Howard Hughes Medical Institute via phys.org》. 2022년 10월 19일에 확인함.
- ↑ 가 나 다 Schoenwolf, Gary C. (2015). 《Larsen's human embryology》 Fif판. Philadelphia, PA. 64쪽. ISBN 9781455706846.
- ↑ Wolpert, Lewis; Tickle, Cheryll; Martinez Arias, Alfonso (2015). 《Principles of Development》 5판. Oxford University Press. 227쪽.
- ↑ Cilia function as calcium-mediated mechanosensors that instruct left-right asymmetry, Science, 5 January 2023, Vol 379, Issue 6627, pp. 71-78; DOI: 10.1126/science.abq7317
- ↑ Immotile cilia mechanically sense the direction of fluid flow for left-right determination, Science, 5 January 2023, Vol 379, Issue 6627, pp. 66-71; DOI: 10.1126/science.abq8148
- ↑ Braun, Daniela A.; Hildebrandt, Friedhelm (2017년 3월 1일). “Ciliopathies”. 《Cold Spring Harbor Perspectives in Biology》 9 (3): a028191. doi:10.1101/cshperspect.a028191. ISSN 1943-0264. PMC 5334254. PMID 27793968.
- ↑ Leitch, Carmen C.; Zaghloul, Norann A.; Davis, Erica E.; Stoetzel, Corinne; Diaz-Font, Anna; Rix, Suzanne; Alfadhel, Majid; Al-Fadhel, Majid; Lewis, Richard Alan; Eyaid, Wafaa; Banin, Eyal (April 2008). “Hypomorphic mutations in syndromic encephalocele genes are associated with Bardet-Biedl syndrome”. 《Nature Genetics》 40 (4): 443–448. doi:10.1038/ng.97. ISSN 1546-1718. PMID 18327255. S2CID 5282929.
- ↑ Yee, Laura E.; Garcia-Gonzalo, Francesc R.; Bowie, Rachel V.; Li, Chunmei; Kennedy, Julie K.; Ashrafi, Kaveh; Blacque, Oliver E.; Leroux, Michel R.; Reiter, Jeremy F. (November 2015). “Conserved Genetic Interactions between Ciliopathy Complexes Cooperatively Support Ciliogenesis and Ciliary Signaling”. 《PLOS Genetics》 11 (11): e1005627. doi:10.1371/journal.pgen.1005627. ISSN 1553-7404. PMC 4635004. PMID 26540106.
- ↑ Cavalier-Smith, T (May 2022). “Ciliary transition zone evolution and the root of the eukaryote tree: implications for opisthokont origin and classification of kingdoms Protozoa, Plantae, and Fungi.”. 《Protoplasma》 259 (3): 487–593. Bibcode:2022Prpls.259..487C. doi:10.1007/s00709-021-01665-7. PMC 9010356. PMID 34940909.
- ↑ McGrath J, Brueckner M (August 2003). “Cilia are at the heart of vertebrate left-right asymmetry”. 《Current Opinion in Genetics & Development》 13 (4): 385–92. doi:10.1016/S0959-437X(03)00091-1. PMID 12888012.
- ↑ Worsley, Calum; Weerakkody, Yuranga (2009년 11월 1일). “Heterotaxy syndrome”. 《Radiopaedia.org》. doi:10.53347/rID-7420. 2022년 6월 10일에 확인함.
- ↑ Kennedy MP, Omran H, Leigh MW, Dell S, Morgan L, Molina PL, Robinson BV, Minnix SL, Olbrich H, Severin T, Ahrens P, Lange L, Morillas HN, Noone PG, Zariwala MA, Knowles MR (June 2007). “Congenital heart disease and other heterotaxic defects in a large cohort of patients with primary ciliary dyskinesia”. 《Circulation》 115 (22): 2814–21. doi:10.1161/CIRCULATIONAHA.106.649038. PMID 17515466.
- ↑ 가 나 다 Newman, Lydia; Chopra, Jagrati; Dossett, Claire; Shepherd, Elizabeth; Bercusson, Amelia; Carroll, Mary; Walker, Woolf; Lucas, Jane S; Cheong, Ying (2023년 5월 2일). “The impact of primary ciliary dyskinesia on female and male fertility: a narrative review”. 《Human Reproduction Update》 29 (3): 347-367. doi:10.1093/humupd/dmad003. PMID 36721921. 2025년 9월 7일에 확인함.
- ↑ 가 나 Horne, Andrew W.; Critchley, H. O. (March 2012). “Mechanisms of disease: the endocrinology of ectopic pregnancy”. 《Expert Reviews in Molecular Medicine》 14. doi:10.1017/erm.2011.2. PMID 22380790. S2CID 10039212.
- ↑ Cano DA, Murcia NS, Pazour GJ, Hebrok M (2004). “orpk mouse model of polycystic kidney disease reveals essential role of primary cilia in pancreatic tissue organization”. 《Development》 131 (14): 3457–3467. doi:10.1242/dev.01189. PMID 15226261.
- ↑ 가 나 Hegyi, P; Petersen, OH (2013). “The exocrine pancreas: the acinar-ductal tango in physiology and pathophysiology.”. 《Reviews of Physiology, Biochemistry and Pharmacology》 165: 1–30. doi:10.1007/112_2013_14. ISBN 978-3-319-00998-8. PMID 23881310.
- ↑ Zhang Q, Davenport JR, Croyle MJ, Haycraft CJ, Yoder BK (2005). “Disruption of IFT results in both exocrine and endocrine abnormalities in the pancreas of Tg737(orpk) mutant mice”. 《Laboratory Investigation》 85 (1): 45–64. doi:10.1038/labinvest.3700207. PMID 15580285.
- ↑ Yamamoto M, Kataoka K (1986). “Electron microscopic observation of the primary cilia in the pancreatic islets”. 《Archivum Histologicum Japonicum》 49 (4): 449–457. doi:10.1679/aohc.49.449. PMID 3545133.
- ↑ Gerdes, Jantje M.; Christou-Savina, Sonia; Xiong, Yan; Moede, Tilo; Moruzzi, Noah; Karlsson-Edlund, Patrick; Leibiger, Barbara; Leibiger, Ingo B.; Östenson, Claes-Göran; Beales, Philip L.; Berggren, Per-Olof (2014). “Ciliary dysfunction impairs beta-cell insulin secretion and promotes development of type 2 diabetes in rodents”. 《Nature Communications》 5. Bibcode:2014NatCo...5.5308G. doi:10.1038/ncomms6308. PMID 25374274. S2CID 41645398.
- ↑ Fastenberg JH, Hsueh WD, Mustafa A, Akbar NA, Abuzeid WM (December 2016). “Biofilms in chronic rhinosinusitis: Pathophysiology and therapeutic strategies”. 《World Journal of Otorhinolaryngology – Head and Neck Surgery》 2 (4): 219–29. doi:10.1016/j.wjorl.2016.03.002. PMC 5698538. PMID 29204570.
- ↑ Dobell, Clifford (1932). 《Antony van Leeuwenhoek and his Little Animals : Being Some Account of the Father of Protozoology & Bacteriology and His Multifarious Discoveries in These Disciplines》. New York: Harcourt, Brace and Company. 119쪽. ISBN 1015536727. 2025년 9월 6일에 확인함.
