Amfibi
| Amfibi | |
|---|---|
| Klasifikasi ilmiah | |
| Kerajaan: | Animalia |
| Filum: | Chordata |
| Klad: | Batrachomorpha |
| Kelas: | Amphibia Gray 1825[3] |
| Subkelas | |
|
(daftar sebagian)
| |
Amfibi atau amfibia adalah hewan vertebrata berkaki empat, anamniotik, dan ektotermik yang menyusun kelas Amphibia. Dalam pengertian luasnya, kelompok ini adalah kelompok parafiletik yang mencakup semua tetrapoda, tetapi mengecualikan amniota (tetrapoda dengan membran amniotik, seperti reptil modern, burung, dan mamalia). Semua amfibi masa kini (yang masih hidup) tergolong dalam subkelas monofiletik Lissamphibia, yang terdiri dari tiga ordo yang masih hidup: Anura (katak dan kodok), Urodela (salamander), dan Gymnophiona (sesilia). Karena berevolusi menjadi hewan yang sebagian besar semiakuatik, amfibi telah beradaptasi untuk menghuni berbagai variasi habitat, dengan sebagian besar spesies hidup di dalam air tawar, lahan basah, atau ekosistem darat (seperti hutan riparian, fosorial, dan bahkan habitat arboreal). Siklus hidup mereka biasanya dimulai sebagai larva akuatik yang memiliki ingsan yang dikenal sebagai berudu, tetapi beberapa spesies telah mengembangkan adaptasi perilaku untuk melewati fase ini.
Amfibi muda umumnya mengalami metamorfosis dari bentuk larva akuatik yang beringsang menjadi bentuk dewasa yang bernapas udara dengan paru-paru. Amfibi menggunakan kulit mereka sebagai antarmuka pernapasan sekunder, dan beberapa salamander darat berukuran kecil serta katak bahkan tidak memiliki paru-paru dan sepenuhnya bergantung pada kulit mereka. Secara fisik mereka mirip dengan reptil seperti kadal, tetapi tidak seperti reptil dan amniota lainnya, mereka memerlukan akses ke badan air untuk berkembang biak. Dengan kebutuhan reproduksi yang kompleks dan kulit yang permeabel, amfibi sering menjadi indikator ekologi bagi kondisi habitat; dalam beberapa dekade terakhir telah terjadi penurunan populasi amfibi yang drastis pada banyak spesies di seluruh dunia.
Amfibi paling awal berevolusi pada periode Devonian dari tetrapodomorph sarcopterygian (ikan sirip-cuping dengan sirip menyerupai tungkai yang bersendi) yang mengembangkan paru-paru primitif, yang berguna untuk beradaptasi dengan daratan kering. Mereka berdiversifikasi dan menjadi dominan secara ekologis selama periode Karbon dan Permian, tetapi kemudian tergeser di lingkungan darat oleh reptil awal dan sinapsida basal (leluhur mamalia). Asal usul lissamphibia modern, yang pertama kali muncul pada Trias Awal, sekitar 250 juta tahun yang lalu, telah lama menjadi perdebatan. Hipotesis paling populer menyatakan bahwa mereka kemungkinan berasal dari temnospondyli, kelompok amfibi prasejarah yang paling beragam, selama periode Permian.[5] Hipotesis lain menyebutkan bahwa mereka muncul dari lepospondyli.[6] Kelompok keempat dari lissamphibia, Albanerpetontidae, punah sekitar 2 juta tahun yang lalu.
Jumlah spesies amfibi yang diketahui adalah sekitar 8.000, di mana hampir 90%-nya adalah katak. Amfibi (dan vertebrata) terkecil di dunia adalah seekor katak dari Nugini (Paedophryne amauensis) dengan panjang hanya 77 mm (3,0 in). Amfibi terbesar yang masih hidup adalah salamander raksasa Tiongkok Selatan (Andrias sligoi) yang berukuran 18 m (59 ft), tetapi ukuran ini masih kalah jauh dibandingkan temnospondyli prasejarah seperti Mastodonsaurus yang dapat mencapai panjang hingga 6 m (20 ft).[7] Studi tentang amfibi disebut batrakologi, sementara studi tentang reptil dan amfibi sekaligus disebut herpetologi.
Klasifikasi
[sunting | sunting sumber]
Kata amphibian berasal dari istilah Yunani Kuno ἀμφίβιος (amphíbios), yang berarti 'kedua jenis kehidupan', ἀμφί berarti 'dari kedua jenis' dan βίος berarti 'kehidupan'. Istilah ini awalnya digunakan sebagai kata sifat umum untuk hewan yang dapat hidup di darat atau di air, termasuk anjing laut dan berang-berang.[8] Secara tradisional, kelas Amphibia mencakup semua vertebrata tetrapoda yang bukan amniota. Amfibi dalam pengertian luasnya (sensu lato) dibagi menjadi tiga subkelas, dua di antaranya telah punah:[9]
- Subkelas Lepospondyli† (Kelompok bentuk-bentuk kecil dari Paleozoikum Akhir yang berpotensi polifiletik, kemungkinan berkerabat lebih dekat dengan amniota daripada Lissamphibia)
- Subkelas Temnospondyli† (tingkatan Paleozoikum Akhir dan Mesozoikum awal yang beragam, beberapa di antaranya adalah predator besar)
- Subkelas Lissamphibia (semua amfibi modern, termasuk katak, kodok, salamander, newt, dan sesilia)
- Salientia (katak, kodok dan kerabatnya): Trias Awal hingga kini—7.360 spesies saat ini dalam 53 famili.[10] Salientia modern (kelompok mahkota) dideskripsikan melalui nama Anura.
- Caudata (salamander, newt dan kerabatnya): Trias Akhir hingga kini—764 spesies saat ini dalam 9 famili.[10] Caudata modern (kelompok mahkota) dideskripsikan melalui nama Urodela.
- Gymnophiona (sesilia dan kerabatnya): Trias Akhir hingga kini—215 spesies saat ini dalam 10 famili.[10] Nama Apoda terkadang juga digunakan untuk sesilia.
- Allocaudata† (Albanerpetontidae) Jura Tengah – Pleistosen Awal
Ketiga subkelas ini tidak mencakup semua amfibi yang telah punah. Kelompok amfibi punah lainnya meliputi Embolomeri (predator akuatik besar Paleozoikum Akhir)[butuh rujukan], Seymouriamorpha (bentuk Permian semiaquatik hingga terestrial yang berkerabat dengan amniota),[butuh rujukan] di antara yang lainnya. Nama-nama seperti Tetrapoda dan Stegocephalia mencakup keseluruhan tetrapoda tingkat-amfibi, sementara Reptiliomorpha atau Anthracosauria digunakan secara bervariasi untuk mendeskripsikan amfibi punah yang berkerabat lebih dekat dengan amniota daripada lissamphibia.

Jumlah spesies sebenarnya dalam setiap kelompok bergantung pada klasifikasi taksonomi yang diikuti. Dua sistem yang paling umum adalah klasifikasi yang diadopsi oleh situs web AmphibiaWeb, Universitas California, Berkeley, dan klasifikasi oleh herpetolog Darrel Frost dan Museum Sejarah Alam Amerika, yang tersedia sebagai basis data referensi daring "Amphibian Species of the World".[11] Angka spesies yang dikutip di atas mengikuti Frost dan jumlah total spesies amfibi (hidup) yang diketahui per 31 Maret 2019, tepatnya 8.000,[12] di mana hampir 90%-nya adalah katak.[13]
Dengan klasifikasi filogenetik, takson Labyrinthodontia telah ditinggalkan karena merupakan kelompok poliparafiletik tanpa fitur penentu yang unik selain karakteristik primitif bersama. Klasifikasi bervariasi menurut filogeni yang disukai penulis dan apakah mereka menggunakan klasifikasi berbasis batang atau berbasis nodus. Secara tradisional, amfibi sebagai kelas didefinisikan sebagai semua tetrapoda dengan tahap larva, sedangkan kelompok yang mencakup leluhur bersama dari semua amfibi hidup (katak, salamander, dan sesilia) beserta semua keturunannya disebut Lissamphibia. Filogeni amfibi Paleozoikum tidak pasti, dan Lissamphibia mungkin saja termasuk dalam kelompok punah, seperti Temnospondyli (secara tradisional ditempatkan dalam subkelas Labyrinthodontia) atau Lepospondyli, dan dalam beberapa analisis bahkan di dalam amniota. Ini berarti bahwa para pendukung tatanama filogenetik telah menghapus sejumlah besar kelompok tetrapoda tipe amfibi Devon dan Karbon basal yang sebelumnya ditempatkan di Amphibia dalam taksonomi Linnaeus, dan memasukkannya ke tempat lain di bawah taksonomi kladistik.[3] Jika leluhur bersama amfibi dan amniota dimasukkan ke dalam Amphibia, ini menjadi kelompok parafiletik.[14]
Semua amfibi modern termasuk dalam subkelas Lissamphibia, yang biasanya dianggap sebagai klad, sekelompok spesies yang telah berevolusi dari leluhur bersama. Tiga ordo modern adalah Anura (katak), Caudata (atau Urodela, salamander), dan Gymnophiona (atau Apoda, sesilia).[15] Telah disarankan bahwa salamander muncul secara terpisah dari leluhur mirip temnospondyli, dan bahkan sesilia adalah kelompok saudara dari amfibi reptiliomorpha tingkat lanjut, dan dengan demikian berkerabat dengan amniota.[16] Meskipun fosil beberapa proto-katak yang lebih tua dengan karakteristik primitif telah diketahui, "katak sejati" tertua, dengan adaptasi melompat adalah Prosalirus bitis, dari Formasi Kayenta Jura Awal di Arizona. Secara anatomis ia sangat mirip dengan katak modern.[17] Sesilia tertua yang diketahui adalah Funcusvermis gilmorei (dari Trias Akhir) dan Eocaecilia micropodia (dari Jura Awal), keduanya dari Arizona.[18] Salamander paling awal adalah Beiyanerpeton jianpingensis dari Jura Akhir Tiongkok timur laut.[19]
Para ahli tidak sepakat mengenai apakah Salientia merupakan superordo yang mencakup ordo Anura, atau apakah Anura adalah sub-ordo dari ordo Salientia. Lissamphibia secara tradisional dibagi menjadi tiga ordo, tetapi famili punah mirip salamander, Albanerpetontidae, sekarang dianggap sebagai bagian dari Lissamphibia bersama superordo Salientia. Selain itu, Salientia mencakup ketiga ordo terkini ditambah proto-katak Trias, Triadobatrachus.[20]
Sejarah evolusi
[sunting | sunting sumber]Kelompok utama pertama amfibi berkembang pada periode Devonian, sekitar 370 juta tahun yang lalu, dari ikan sirip-cuping yang mirip dengan coelacanth dan lungfish modern.[21] Ikan sirip-cuping purba ini telah mengevolusikan sirip menyerupai kaki dengan banyak sendi serta jari-jari yang memungkinkan mereka merangkak di sepanjang dasar laut. Beberapa ikan telah mengembangkan paru-paru primitif yang membantu mereka menghirup udara ketika kolam-kolam tergenang di rawa-rawa Devonian memiliki kadar oksigen rendah. Mereka juga dapat menggunakan sirip kuat mereka untuk mengangkat diri keluar dari air ke daratan kering jika keadaan mengharuskan demikian. Akhirnya, sirip bertulang mereka akan berevolusi menjadi tungkai dan mereka akan menjadi leluhur bagi semua tetrapoda, termasuk amfibi modern, reptil, burung, dan mamalia. Meskipun mampu merangkak di darat, banyak dari ikan tetrapodomorpha prasejarah ini masih menghabiskan sebagian besar waktu mereka di dalam air. Mereka mulai mengembangkan paru-paru, tetapi masih bernapas terutama menggunakan insang.[22]
Banyak contoh spesies yang menunjukkan fitur transisi telah ditemukan. Ichthyostega adalah salah satu amfibi primitif pertama, dengan lubang hidung dan paru-paru yang lebih efisien. Ia memiliki empat tungkai yang kokoh, leher, ekor dengan sirip, dan tengkorak yang sangat mirip dengan ikan sirip-cuping, Eusthenopteron.[21] Amfibi mengevolusikan adaptasi yang memungkinkan mereka tinggal di luar air untuk periode yang lebih lama. Paru-paru mereka membaik dan kerangka mereka menjadi lebih berat dan kuat, lebih mampu menopang berat tubuh mereka di darat.Mereka mengembangkan "tangan" dan "kaki" dengan lima jari atau lebih;[23] kulit menjadi lebih mampu menahan cairan tubuh dan menahan pengeringan (desikasi).[22] Tulang hyomandibula ikan di wilayah hyoid di belakang insang menyusut ukurannya dan menjadi stapes pada telinga amfibi, sebuah adaptasi yang diperlukan untuk mendengar di daratan kering.[24] Kekerabatan antara amfibi dan ikan teleostei terlihat pada struktur gigi yang berlipat ganda dan tulang supra-oksipital berpasangan di bagian belakang kepala, di mana kedua fitur ini tidak ditemukan di tempat lain dalam kerajaan hewan.[25]

Pada akhir periode Devonian (360 juta tahun yang lalu), laut, sungai, dan danau dipenuhi dengan kehidupan sementara daratan dikuasai tanaman awal dan tanpa vertebrata,[25] meskipun beberapa di antaranya, seperti Ichthyostega, mungkin terkadang menyeret diri mereka keluar dari air. Diperkirakan mereka mungkin mendorong diri dengan tungkai depan, menyeret bagian belakang tubuh mereka dengan cara yang mirip dengan yang digunakan oleh gajah laut.[23] Pada awal Karbon (360 hingga 323 juta tahun yang lalu), iklim relatif basah dan hangat. Rawa-rawa yang luas berkembang dengan lumut, pakis, paku ekor kuda, dan calamites. Arthropoda bernapas udara berevolusi dan menginvasi daratan di mana mereka menyediakan makanan bagi amfibi karnivora yang mulai beradaptasi dengan lingkungan terestrial. Tidak ada tetrapoda lain di darat dan amfibi berada di puncak rantai makanan, dengan beberapa menempati posisi ekologis yang saat ini dipegang oleh buaya. Meskipun dilengkapi dengan tungkai dan kemampuan bernapas udara, sebagian besar masih memiliki tubuh meruncing yang panjang dan ekor yang kuat.[25] Yang lain adalah predator darat puncak, kadang-kadang mencapai panjang beberapa meter, memangsa serangga besar pada periode tersebut dan banyak jenis ikan di air. Mereka masih perlu kembali ke air untuk meletakkan telur tanpa cangkang mereka, dan bahkan sebagian besar amfibi modern memiliki tahap larva akuatik sepenuhnya dengan insang seperti leluhur ikan mereka. Perkembangan telur amniotik, yang mencegah embrio berkembang menjadi kering, adalah yang memungkinkan reptil untuk bereproduksi di darat dan yang mengarah pada dominasi mereka pada periode berikutnya.[21]
Setelah runtuhnya hutan hujan Karbon, dominasi amfibi digantikan oleh reptil,[26] dan amfibi semakin hancur akibat peristiwa kepunahan Permian–Trias.[27] Selama Periode Trias (252 hingga 201 juta tahun yang lalu), reptil terus mengungguli kompetisi dengan amfibi, yang menyebabkan pengurangan baik dalam ukuran amfibi maupun peran penting mereka di biosfer. Menurut catatan fosil, Lissamphibia, yang mencakup semua amfibi modern dan merupakan satu-satunya garis keturunan yang bertahan, mungkin telah bercabang dari kelompok punah Temnospondyli dan Lepospondyli pada periode antara Karbon Akhir dan Trias Awal. Kelangkaan relatif bukti fosil menghalangi penanggalan yang tepat,[22] namun studi molekuler terbaru, berdasarkan multilocus sequence typing, menunjukkan asal usul Permian Awal bagi amfibi yang masih ada (extant).[28]

Asal usul dan hubungan evolusioner antara tiga kelompok utama amfibi masih menjadi perdebatan. Sebuah filogeni molekuler tahun 2005, berdasarkan analisis rDNA, menunjukkan bahwa salamander dan sesilia berkerabat lebih dekat satu sama lain dibandingkan dengan katak. Tampaknya juga divergensi ketiga kelompok tersebut terjadi pada Paleozoikum atau awal Mesozoikum (sekitar 250 juta tahun yang lalu), sebelum pecahnya superbenua Pangea dan segera setelah divergensi mereka dari ikan sirip-cuping. Singkatnya periode ini, dan cepatnya radiasi terjadi, akan membantu menjelaskan kelangkaan relatif fosil amfibi primitif.[29] Terdapat celah besar dalam catatan fosil, penemuan temnospondyli dissorophoid Gerobatrachus dari Permian Awal di Texas pada tahun 2008 memberikan mata rantai yang hilang dengan banyak karakteristik katak modern.[16] Analisis molekuler menunjukkan bahwa divergensi katak–salamander terjadi jauh lebih awal daripada yang ditunjukkan oleh bukti paleontologis.[16] Satu studi menunjukkan bahwa leluhur bersama terakhir dari semua amfibi modern hidup sekitar 315 juta tahun yang lalu, dan bahwa temnospondyli stereospondyl adalah kerabat terdekat dari sesilia.[30] Namun, sebagian besar studi mendukung asal usul monofiletik tunggal dari semua amfibi modern dalam temnospondyli dissorophoid.[5]
Saat mereka berevolusi dari ikan berparu-paru, amfibi harus membuat adaptasi tertentu untuk hidup di darat, termasuk kebutuhan untuk mengembangkan sarana lokomosi baru. Di air, dorongan ke samping dari ekor mereka telah mendorong mereka maju, tetapi di darat, mekanisme yang sangat berbeda diperlukan. Kolom vertebra, tungkai, gelang tungkai, dan perototan mereka harus cukup kuat untuk mengangkat mereka dari tanah untuk lokomosi dan makan. Amfibi dewasa terestrial membuang sistem garis rusuk mereka dan mengadaptasi sistem sensorik mereka untuk menerima rangsangan melalui media udara. Mereka perlu mengembangkan metode baru untuk mengatur panas tubuh mereka guna mengatasi fluktuasi suhu lingkungan. Mereka mengembangkan perilaku yang sesuai untuk reproduksi di lingkungan terestrial. Kulit mereka terpapar sinar ultraviolet yang berbahaya yang sebelumnya diserap oleh air. Kulit berubah menjadi lebih protektif dan mencegah kehilangan air yang berlebihan.[31]
Karakteristik
[sunting | sunting sumber]Superkelas Tetrapoda dibagi menjadi empat kelas hewan vertebrata dengan empat tungkai.[32] Reptil, burung, dan mamalia adalah amniota, yang telurnya diletakkan atau dibawa oleh betina dan dikelilingi oleh beberapa membran, yang sebagian di antaranya kedap air.[33] Karena tidak memiliki membran-membran ini, amfibi memerlukan badan air untuk reproduksi, meskipun beberapa spesies telah mengembangkan berbagai strategi untuk melindungi atau melewati tahap larva akuatik yang rentan.[31] Mereka tidak ditemukan di laut kecuali satu atau dua katak yang hidup di air payau di rawa bakau;[34] sementara salamander Anderson terdapat di danau air payau atau asin.[35] Di darat, amfibi terbatas pada habitat lembap karena kebutuhan untuk menjaga kulit mereka tetap basah.[31]
Amfibi modern memiliki anatomi yang disederhanakan dibandingkan dengan leluhur mereka karena pedomorfosis, yang disebabkan oleh dua tren evolusi: miniaturisasi dan genom yang luar biasa besar, yang mengakibatkan laju pertumbuhan dan perkembangan yang lebih lambat dibandingkan dengan vertebrata lain.[36][37] Alasan lain untuk ukuran mereka terkait dengan metamorfosis cepat mereka, yang tampaknya hanya berevolusi pada leluhur Lissamphibia; pada semua garis keturunan lain yang diketahui, perkembangannya jauh lebih bertahap. Karena perombakan aparatus makan berarti mereka tidak makan selama metamorfosis, metamorfosis harus berjalan lebih cepat semakin kecil individunya, sehingga ini terjadi pada tahap awal ketika larva masih kecil. (Spesies salamander terbesar tidak melalui metamorfosis.)[38] Amfibi yang bertelur di darat sering kali melewati seluruh metamorfosis di dalam telur. Telur terestrial anamniotik berdiameter kurang dari 1 cm karena masalah difusi, ukuran yang membatasi jumlah pertumbuhan pasca penetasan.[39]
Amfibi (dan vertebrata) terkecil di dunia adalah katak microhylid dari Nugini (Paedophryne amauensis) yang pertama kali ditemukan pada tahun 2012. Katak ini memiliki panjang rata-rata 77 mm (3,0 in) dan merupakan bagian dari genus yang mencakup empat dari sepuluh spesies katak terkecil di dunia.[40] Amfibi hidup terbesar adalah salamander raksasa Tiongkok (Andrias davidianus) yang berukuran 18 m (59 ft),[41] namun ini jauh lebih kecil daripada amfibi terbesar yang pernah ada—Prionosuchus yang telah punah dengan panjang 9 m (30 ft), sejenis temnospondyli mirip buaya yang berasal dari 270 juta tahun lalu dari Permian tengah Brasil.[42] Katak terbesar adalah katak Goliath Afrika (Conraua goliath), yang dapat mencapai 32 cm (13 in) dan berat 3 kg (6,6 pon).[41]
Amfibi adalah vertebrata ektotermik (berdarah dingin) yang tidak mempertahankan suhu tubuh mereka melalui proses fisiologis internal. Laju metabolisme mereka rendah dan sebagai akibatnya, kebutuhan makanan dan energi mereka terbatas. Dalam keadaan dewasa, mereka memiliki saluran air mata dan kelopak mata yang dapat bergerak, dan sebagian besar spesies memiliki telinga yang dapat mendeteksi getaran di udara atau tanah. Mereka memiliki lidah berotot, yang pada banyak spesies dapat dijulurkan. Amfibi modern memiliki tulang belakang yang sepenuhnya terosifikasi dengan prosesus artikular. Tulang rusuk mereka biasanya pendek dan mungkin menyatu dengan tulang belakang. Tengkorak mereka sebagian besar lebar dan pendek, dan sering kali tidak terosifikasi sepenuhnya. Kulit mereka mengandung sedikit keratin dan tidak memiliki sisik, selain beberapa sisik mirip ikan pada sesilia tertentu. Kulit mengandung banyak kelenjar mukosa dan pada beberapa spesies, kelenjar racun (sejenis kelenjar granular). Jantung amfibi memiliki tiga ruang, dua atrium dan satu ventrikel. Mereka memiliki kandung kemih dan produk limbah nitrogen diekskresikan terutama sebagai urea. Sebagian besar amfibi meletakkan telur mereka di air dan memiliki larva akuatik yang mengalami metamorfosis menjadi dewasa terestrial. Amfibi bernapas melalui aksi pompa di mana udara pertama-tama ditarik ke wilayah bucofaringeal melalui lubang hidung. Lubang hidung ini kemudian ditutup dan udara dipaksa masuk ke paru-paru dengan kontraksi tenggorokan.[43] Mereka melengkapi ini dengan pertukaran gas melalui kulit.[31]
Anura
[sunting | sunting sumber]
Ordo Anura (dari Yunani Kuno a(n)- yang berarti "tanpa" dan oura yang berarti "ekor") terdiri dari katak dan kodok. Mereka biasanya memiliki tungkai belakang panjang yang melipat di bawah tubuh, tungkai depan yang lebih pendek, jari berselaput tanpa cakar, tidak berekor, mata besar, dan kulit lembap berkelenjar.[15] Anggota ordo ini yang berkulit halus umumnya disebut sebagai katak, sedangkan yang berkulit kutil (kasar) dikenal sebagai kodok. Perbedaan ini bukan merupakan perbedaan formal secara taksonomi dan terdapat banyak pengecualian terhadap aturan ini. Anggota famili Bufonidae dikenal sebagai "kodok sejati".[44] Ukuran katak bervariasi dari katak Goliath (Conraua goliath) dari Afrika Barat yang berukuran 30-sentimeter (12 in)[45] hingga Paedophryne amauensis berukuran 77-milimeter (3,0 in), yang pertama kali dideskripsikan di Papua Nugini pada tahun 2012, yang juga merupakan vertebrata terkecil yang diketahui.[46] Meskipun sebagian besar spesies berasosiasi dengan air dan habitat lembap, beberapa terspesialisasi untuk hidup di pepohonan atau di gurun. Mereka ditemukan di seluruh dunia kecuali di daerah kutub.[47]
Anura dibagi menjadi tiga subordo yang diterima secara luas oleh komunitas ilmiah, tetapi hubungan antara beberapa famili masih belum jelas. Studi molekuler masa depan diharapkan dapat memberikan wawasan lebih lanjut mengenai hubungan evolusioner mereka.[48] Subordo Archaeobatrachia berisi empat famili katak primitif. Famili-famili tersebut adalah Ascaphidae, Bombinatoridae, Discoglossidae, dan Leiopelmatidae yang memiliki sedikit fitur turunan dan kemungkinan bersifat parafiletik sehubungan dengan garis keturunan katak lainnya.[49] Enam famili dalam subordo Mesobatrachia yang secara evolusi lebih maju adalah Megophryidae fosorial, Pelobatidae, Pelodytidae, Scaphiopodidae, dan Rhinophrynidae serta Pipidae yang secara obligat bersifat akuatik. Mereka memiliki karakteristik tertentu yang merupakan perantara antara dua subordo lainnya.[49] Neobatrachia sejauh ini merupakan subordo terbesar dan mencakup famili katak modern lainnya, termasuk sebagian besar spesies yang umum ditemukan. Sekitar 96% dari lebih dari 5.000 spesies katak yang masih ada adalah neobatrachia.[50]
Caudata
[sunting | sunting sumber]
(Andrias japonicus), salamander primitif
Ordo Caudata (dari bahasa Latin cauda yang berarti "ekor") terdiri dari salamander—hewan memanjang dan bertubuh rendah yang sebagian besar menyerupai kadal dalam bentuknya. Ini adalah sifat simplesiomorfik dan kekerabatan mereka dengan kadal tidak lebih dekat daripada kekerabatan mereka dengan mamalia.[51] Salamander tidak memiliki cakar, memiliki kulit bebas sisik, baik halus maupun tertutup tuberkel, serta ekor yang biasanya pipih dari sisi ke sisi dan sering kali bersirip. Ukuran mereka berkisar dari salamander raksasa Tiongkok (Andrias davidianus), yang dilaporkan tumbuh hingga panjang 18 meter (59 ft),[52] hingga Thorius pennatulus yang mungil dari Meksiko yang jarang melebihi panjang 20 mm (0,8 in).[53] Salamander memiliki persebaran sebagian besar Laurasia, hadir di banyak wilayah Holarktik di belahan bumi utara. Famili Plethodontidae juga ditemukan di Amerika Tengah dan Amerika Selatan di sebelah utara cekungan Amazon;[47] Amerika Selatan tampaknya diinvasi dari Amerika Tengah sekitar awal Miosen, 23 juta tahun yang lalu.[54] Urodela adalah nama yang terkadang digunakan untuk semua spesies salamander yang masih ada (extant).[55] Anggota dari beberapa famili salamander telah menjadi pedomorfik dan gagal menyelesaikan metamorfosis mereka atau mempertahankan beberapa karakteristik larva saat dewasa.[56] Sebagian besar salamander memiliki panjang di bawah 15 cm (5,9 in). Mereka bisa bersifat terestrial atau akuatik dan banyak yang menghabiskan sebagian tahun di setiap habitat. Saat di darat, mereka sebagian besar menghabiskan hari bersembunyi di bawah batu atau kayu gelondongan atau di vegetasi lebat, muncul di sore dan malam hari untuk mencari makan cacing, serangga, dan invertebrata lainnya.[47]

(Triturus dobrogicus), salamander tingkat lanjut
Subordo Cryptobranchoidea berisi salamander primitif. Sejumlah fosil cryptobranchid telah ditemukan, tetapi hanya ada tiga spesies yang masih hidup, yaitu salamander raksasa Tiongkok (Andrias davidianus), salamander raksasa Jepang (Andrias japonicus), dan hellbender (Cryptobranchus alleganiensis) dari Amerika Utara. Amfibi besar ini mempertahankan beberapa karakteristik larva dalam keadaan dewasa mereka; celah insang tetap ada dan mata tidak berkelopak. Fitur uniknya adalah kemampuan mereka untuk makan dengan cara menghisap, menekan sisi kiri rahang bawah mereka atau sisi kanan.[57] Pejantan menggali sarang, membujuk betina untuk meletakkan untaian telur mereka di dalamnya, dan menjaganya. Selain bernapas dengan paru-paru, mereka berespirasi melalui banyak lipatan di kulit tipis mereka, yang memiliki kapiler dekat dengan permukaan.[58]
Subordo Salamandroidea berisi salamander tingkat lanjut. Mereka berbeda dari cryptobranchid karena memiliki tulang preartikular yang menyatu di rahang bawah, dan dengan menggunakan pembuahan internal. Pada salamandrid, pejantan menaruh paket sperma, spermatofora, dan betina mengambilnya dan memasukkannya ke dalam kloakanya di mana sperma disimpan sampai telur diletakkan.[59] Famili terbesar dalam kelompok ini adalah Plethodontidae, salamander tanpa paru-paru, yang mencakup 60% dari semua spesies salamander. Famili Salamandridae mencakup salamander sejati dan nama "newt" diberikan kepada anggota subfamilinya, Pleurodelinae.[15]
Subordo ketiga, Sirenoidea, berisi empat spesies siren, yang berada dalam satu famili, Sirenidae. Anggota ordo ini adalah salamander akuatik mirip belut dengan tungkai depan yang sangat tereduksi dan tidak ada tungkai belakang. Beberapa fitur mereka primitif sementara yang lain merupakan turunan.[60] Pembuahan kemungkinan besar bersifat eksternal karena sirenid tidak memiliki kelenjar kloaka yang digunakan oleh salamandrid jantan untuk menghasilkan spermatofora dan betina tidak memiliki spermateka untuk penyimpanan sperma. Meskipun demikian, telur diletakkan satu per satu, perilaku yang tidak kondusif untuk pembuahan eksternal.[59]
Gymnophiona
[sunting | sunting sumber]
Ordo Gymnophiona (dari bahasa Yunani gymnos yang berarti "telanjang" dan ophis yang berarti "ular") atau Apoda mencakup sesilia. Mereka adalah hewan yang panjang, silindris, tanpa tungkai dengan bentuk menyerupai ular atau cacing. Hewan dewasa memiliki panjang yang bervariasi dari 8 hingga 75 sentimeter (3 hingga 30 inci) dengan pengecualian pada sesilia Thomson (Caecilia thompsoni), yang dapat mencapai 150 cm (59 in). Kulit sesilia memiliki sejumlah besar lipatan transversal dan pada beberapa spesies mengandung sisik dermal kecil yang tertanam. Ia memiliki mata rudimenter yang tertutup kulit, yang mungkin terbatas hanya untuk membedakan perbedaan intensitas cahaya. Ia juga memiliki sepasang tentakel pendek di dekat mata yang dapat dijulurkan dan memiliki fungsi taktil serta olfaktori. Sebagian besar sesilia hidup di bawah tanah dalam liang di tanah yang lembap, di kayu busuk, dan di bawah serasah tanaman, tetapi beberapa bersifat akuatik.[61] Sebagian besar spesies meletakkan telur mereka di bawah tanah dan ketika larva menetas, mereka menuju ke badan air terdekat. Yang lain mengerami telur mereka dan larva mengalami metamorfosis sebelum telur menetas. Beberapa spesies melahirkan anak hidup, memberi mereka makan dengan sekresi kelenjar saat mereka berada di dalam oviduk.[62] Sesilia memiliki persebaran yang sebagian besar Gondwana, ditemukan di wilayah tropis Afrika, Asia, serta Amerika Tengah dan Selatan.[63]
Anatomi dan fisiologi
[sunting | sunting sumber]Kulit
[sunting | sunting sumber]
Struktur integumen mengandung beberapa karakteristik khas yang umum pada vertebrata terestrial, seperti adanya lapisan luar yang sangat terkornifikasi, yang diperbarui secara berkala melalui proses ganti kulit (molting) yang dikontrol oleh kelenjar pituitari dan tiroid. Penebalan lokal (sering disebut kutil) adalah hal umum, seperti yang ditemukan pada kodok. Bagian luar kulit dilepaskan secara berkala sebagian besar dalam satu kesatuan, berbeda dengan mamalia dan burung di mana kulit dilepaskan dalam bentuk serpihan. Amfibi sering memakan kulit yang terkelupas tersebut.[47] Sesilia unik di antara amfibi karena memiliki sisik dermal termineralisasi yang tertanam di dalam dermis di antara alur-alur kulit. Kemiripan sisik ini dengan sisik ikan bertulang sebagian besar hanya bersifat superfisial. Kadal dan beberapa katak memiliki osteodermata yang agak mirip yang membentuk deposit tulang di dermis, tetapi ini adalah contoh evolusi konvergen dengan struktur serupa yang muncul secara independen dalam garis keturunan vertebrata yang beragam.[64]

- A. Kelenjar mukosa
- B. Kromatofora
- C. Kelenjar racun granular
- D. Jaringan ikat
- E. Stratum korneum
- F. Zona transisi
- G. Epidermis
- H. Dermis
Kulit amfibi permeabel terhadap air. Pertukaran gas dapat terjadi melalui kulit (respirasi kutan) dan ini memungkinkan amfibi dewasa untuk bernapas tanpa naik ke permukaan air dan untuk berhibernasi di dasar kolam.[47] Untuk mengompensasi kulit mereka yang tipis dan halus, amfibi telah mengembangkan kelenjar mukosa, terutama di kepala, punggung, dan ekor mereka. Sekresi yang dihasilkan oleh kelenjar ini membantu menjaga kulit tetap lembap. Selain itu, sebagian besar spesies amfibi memiliki kelenjar granular yang mengeluarkan zat yang tidak enak atau beracun. Beberapa racun amfibi bisa mematikan bagi manusia sementara yang lain hanya memiliki sedikit efek.[65] Kelenjar penghasil racun utama, parotoid, menghasilkan neurotoksin bufotoksin dan terletak di belakang telinga kodok, di sepanjang punggung katak, di belakang mata salamander, dan di permukaan atas sesilia.[66]
Warna kulit amfibi dihasilkan oleh tiga lapisan sel pigmen yang disebut kromatofora. Tiga lapisan sel ini terdiri dari melanofora (menempati lapisan terdalam), guanofora (membentuk lapisan perantara dan mengandung banyak butiran, menghasilkan warna biru-hijau), dan lipofora (kuning, lapisan paling luar). Perubahan warna yang ditampilkan oleh banyak spesies dipicu oleh hormon yang disekresikan oleh kelenjar pituitari. Tidak seperti ikan bertulang, tidak ada kontrol langsung sel pigmen oleh sistem saraf, dan ini mengakibatkan perubahan warna terjadi lebih lambat daripada yang terjadi pada ikan. Kulit berwarna cerah biasanya menunjukkan bahwa spesies tersebut beracun dan merupakan tanda peringatan bagi predator.[67]
Sistem rangka dan lokomosi
[sunting | sunting sumber]
Amfibi memiliki sistem rangka yang secara struktural homolog dengan tetrapoda lainnya, meskipun dengan sejumlah variasi. Mereka semua memiliki empat tungkai kecuali sesilia tanpa kaki dan beberapa spesies salamander dengan tungkai yang tereduksi atau tanpa tungkai. Tulang-tulangnya berongga dan ringan. Sistem muskuloskeletalnya kuat untuk memungkinkannya menopang kepala dan tubuh. Tulang-tulangnya sepenuhnya terosifikasi dan vertebra saling mengunci satu sama lain melalui prosesus yang tumpang tindih. Gelang bahu didukung oleh otot, dan gelang panggul yang berkembang baik melekat pada tulang punggung oleh sepasang tulang rusuk sakral. Ilium miring ke depan dan tubuh ditahan lebih dekat ke tanah dibandingkan pada mamalia.[68]

(Ceratophrys cornuta)
Pada sebagian besar amfibi, terdapat empat jari pada kaki depan dan lima pada kaki belakang, tetapi tidak ada cakar pada keduanya. Beberapa salamander memiliki jumlah jari yang lebih sedikit dan amphiuma terlihat seperti belut dengan kaki kecil yang gemuk. Siren adalah salamander akuatik dengan tungkai depan yang pendek dan tebal serta tidak memiliki tungkai belakang. Sesilia tidak memiliki tungkai. Mereka menggali dengan cara seperti cacing tanah dengan zona kontraksi otot yang bergerak di sepanjang tubuh. Di permukaan tanah atau di air mereka bergerak dengan menggelombangkan tubuh mereka dari sisi ke sisi.[69]
Pada katak, kaki belakang lebih besar daripada kaki depan, terutama pada spesies yang utamanya bergerak dengan melompat atau berenang. Pada tipe pejalan kaki dan pelari, tungkai belakang tidak terlalu besar, dan tipe penggali sebagian besar memiliki tungkai pendek dan tubuh lebar. Kaki memiliki adaptasi untuk cara hidupnya, dengan selaput di antara jari-jari kaki untuk berenang, bantalan jari perekat yang lebar untuk memanjat, dan tuberkel berkeratin pada kaki belakang untuk menggali (katak biasanya menggali mundur ke dalam tanah). Pada sebagian besar salamander, tungkai pendek dan kurang lebih sama panjangnya serta menonjol pada sudut siku-siku dari tubuh. Lokomosi di darat dilakukan dengan berjalan dan ekor sering berayun dari sisi ke sisi atau digunakan sebagai penyangga, terutama saat memanjat. Dalam gaya berjalan normal mereka, hanya satu kaki yang dimajukan pada satu waktu dengan cara yang diadopsi oleh leluhur mereka, ikan sirip-cuping.[68] Beberapa salamander dalam genus Aneides dan plethodontid tertentu memanjat pohon dan memiliki tungkai panjang, bantalan jari besar, dan ekor prehensil.[59] Pada salamander akuatik dan pada berudu katak, ekor memiliki sirip dorsal dan ventral dan digerakkan dari sisi ke sisi sebagai alat propulsi. Katak dewasa tidak memiliki ekor dan sesilia hanya memiliki ekor yang sangat pendek.[69]

Salamander menggunakan ekor mereka untuk pertahanan dan beberapa siap melepaskannya untuk menyelamatkan hidup mereka dalam proses yang dikenal sebagai autotomi. Spesies tertentu dalam Plethodontidae memiliki zona lemah di pangkal ekor dan menggunakan strategi ini dengan mudah. Ekor sering terus berkedut setelah pemisahan yang dapat mengalihkan perhatian penyerang dan memungkinkan salamander melarikan diri. Baik ekor maupun tungkai dapat diregenerasi.[70] Katak dewasa tidak dapat menumbuhkan kembali tungkai tetapi berudu dapat melakukannya.[69]
Sistem peredaran darah
[sunting | sunting sumber]
- Insang internal tempat darah mengalami reoksigenasi
- Titik di mana darah kehabisan oksigen dan kembali ke jantung melalui pembuluh balik (vena)
- Jantung beruang dua
Amfibi memiliki tahap juvenil dan tahap dewasa, dengan sistem peredaran darah yang berbeda pada kedua tahap tersebut. Pada tahap juvenil (atau berudu), sirkulasi darahnya mirip dengan ikan; jantung beruang dua memompa darah melalui insang tempat darah dioksigenasi, lalu disebarkan ke seluruh tubuh dan kembali ke jantung dalam satu putaran tunggal. Pada tahap dewasa, amfibi (terutama katak) kehilangan insang dan mengembangkan paru-paru. Mereka memiliki jantung yang terdiri dari satu ventrikel dan dua atrium. Ketika ventrikel mulai berkontraksi, darah terdeoksigenasi (miskin oksigen) dipompa melalui arteri pulmonalis menuju paru-paru. Kontraksi yang berlanjut kemudian memompa darah teroksigenasi ke seluruh tubuh. Percampuran kedua aliran darah tersebut diminimalkan oleh anatomi ruang-ruang jantung.[71]
Sistem saraf dan indra
[sunting | sunting sumber]Sistem saraf pada dasarnya sama dengan vertebrata lain, dengan otak pusat, sumsum tulang belakang, dan saraf di seluruh tubuh. Otak amfibi relatif sederhana namun secara struktur luas sama dengan reptil, burung, dan mamalia. Otak mereka memanjang, kecuali pada sesilia, dan memuat area motorik dan sensorik yang biasa terdapat pada tetrapoda.[72] Badan pineal, yang diketahui mengatur pola tidur pada manusia, diperkirakan memproduksi hormon yang terlibat dalam hibernasi dan estivasi pada amfibi.[73]
Berudu mempertahankan sistem garis rusuk dari leluhur ikan mereka, tetapi sistem ini hilang pada amfibi dewasa terestrial. Banyak salamander akuatik dan beberapa sesilia memiliki elektroreseptor yang disebut organ ampula (sama sekali tidak ada pada anura), yang memungkinkan mereka menemukan objek di sekitar mereka saat terendam air.[74] Telinga berkembang dengan baik pada katak. Tidak ada telinga luar, tetapi gendang telinga (timpanum) bundar yang besar terletak di permukaan kepala tepat di belakang mata. Bagian ini bergetar dan suara ditransmisikan melalui tulang tunggal, stapes, ke telinga dalam. Hanya suara berfrekuensi tinggi seperti panggilan kawin yang didengar dengan cara ini, tetapi suara berfrekuensi rendah dapat dideteksi melalui mekanisme lain.[68] Terdapat sekumpulan sel rambut khusus, yang disebut papilla amphibiorum, di telinga dalam yang mampu mendeteksi suara yang lebih dalam. Fitur lain, yang unik pada katak dan salamander, adalah kompleks kolumela-operkulum yang bersebelahan dengan kapsul pendengaran yang terlibat dalam transmisi sinyal udara maupun seismik (getaran tanah).[75] Telinga salamander dan sesilia kurang berkembang dibandingkan katak karena mereka biasanya tidak berkomunikasi satu sama lain melalui perantara suara.[76]
Mata berudu tidak memiliki kelopak, tetapi saat metamorfosis, kornea menjadi lebih berbentuk kubah, lensa menjadi lebih datar, serta kelopak mata dan kelenjar serta saluran terkait berkembang.[68] Mata dewasa merupakan peningkatan dari mata invertebrata dan merupakan langkah pertama dalam pengembangan mata vertebrata yang lebih maju. Mata ini memungkinkan penglihatan warna dan kedalaman fokus. Pada retina terdapat sel batang hijau, yang reseptif terhadap berbagai panjang gelombang.[76]
Sistem pencernaan dan ekskresi
[sunting | sunting sumber]
- Atrium kanan
- Hati
- Aorta
- Massa telur
- Usus besar (Kolon)
- Atrium kiri
- Ventrikel
- Lambung
- Paru-paru kiri
- Limpa
- Usus halus
- Kloaka
Banyak amfibi menangkap mangsanya dengan menjentikkan lidah yang memanjang dengan ujung lengket dan menariknya kembali ke dalam mulut sebelum mencengkeram mangsa tersebut dengan rahang mereka. Beberapa menggunakan makan inersia untuk membantu menelan mangsa, dengan menyentakkan kepala ke depan secara berulang dan tajam yang menyebabkan makanan bergerak mundur di dalam mulut mereka karena inersia. Sebagian besar amfibi menelan mangsanya secara utuh tanpa banyak mengunyah sehingga mereka memiliki lambung yang bervolume besar. Esofagus yang pendek dilapisi dengan silia yang membantu memindahkan makanan ke lambung, dan mukus yang diproduksi oleh kelenjar di mulut dan faring melancarkan jalannya makanan. Enzim kitinase yang diproduksi di lambung membantu mencerna kutikula kitin dari mangsa arthropoda.[77]
Amfibi memiliki pankreas, hati, dan kandung empedu. Hati biasanya besar dengan dua lobus. Ukurannya ditentukan oleh fungsinya sebagai unit penyimpanan glikogen dan lemak, dan dapat berubah seiring musim saat cadangan ini dibangun atau digunakan. Jaringan adiposa adalah sarana penting lainnya untuk menyimpan energi dan ini terjadi di perut (dalam struktur internal yang disebut badan lemak), di bawah kulit dan, pada beberapa salamander, di ekor.[78] Terdapat dua ginjal yang terletak di bagian dorsal, di dekat atap rongga tubuh. Tugas ginjal adalah menyaring darah dari limbah metabolisme dan mengangkut urin melalui ureter ke kandung kemih tempat urin disimpan sebelum dikeluarkan secara berkala melalui lubang kloaka. Larva dan sebagian besar amfibi dewasa akuatik mengekskresikan nitrogen sebagai amonia dalam urin encer berjumlah besar, sementara spesies terestrial, dengan kebutuhan yang lebih besar untuk menghemat air, mengekskresikan urea yang kurang beracun. Beberapa katak pohon dengan akses terbatas ke air mengekskresikan sebagian besar limbah metabolisme mereka sebagai asam urat.[79]
Kandung kemih
[sunting | sunting sumber]Sebagian besar amfibi akuatik dan semi-akuatik memiliki kulit bermembran yang memungkinkan mereka menyerap air secara langsung melaluinya. Beberapa hewan semi-akuatik juga memiliki membran kandung kemih yang permeabel serupa.[80] Akibatnya, mereka cenderung memiliki tingkat produksi urin yang tinggi untuk mengimbangi asupan air yang tinggi ini, dan memiliki urin yang rendah garam terlarut. Kandung kemih membantu hewan semacam itu untuk menahan garam. Beberapa amfibi akuatik seperti Xenopus tidak menyerap kembali air, untuk mencegah masuknya air yang berlebihan.[81] Bagi amfibi yang tinggal di darat, dehidrasi menyebabkan berkurangnya keluaran urin.[82]
Kandung kemih amfibi biasanya sangat distensibel (dapat melar) dan pada beberapa spesies katak dan salamander yang tinggal di darat dapat mencapai antara 20% dan 50% dari total berat badan mereka.[82] Urin mengalir dari ginjal melalui ureter ke dalam kandung kemih dan secara berkala dilepaskan dari kandung kemih ke kloaka.[83]
Sistem pernapasan
[sunting | sunting sumber]
Paru-paru pada amfibi tergolong primitif dibandingkan dengan paru-paru amniota, karena hanya memiliki sedikit septa internal dan alveoli yang besar, sehingga memiliki laju difusi oksigen yang masuk ke dalam darah yang relatif lambat. Ventilasi dicapai melalui mekanisme pompa bukal.[84] Namun, sebagian besar amfibi mampu melakukan pertukaran gas dengan air atau udara melalui kulit mereka. Untuk memungkinkan respirasi kutan yang memadai, permukaan kulit mereka yang sangat tervaskularisasi harus tetap lembap agar oksigen dapat berdifusi dengan laju yang cukup tinggi.[77] Karena konsentrasi oksigen di dalam air meningkat pada suhu rendah dan laju aliran tinggi, amfibi akuatik dalam situasi ini dapat mengandalkan respirasi kutan sebagai metode utama, seperti pada katak air Titicaca dan salamander hellbender. Di udara, di mana konsentrasi oksigen lebih tinggi, beberapa spesies kecil dapat mengandalkan pertukaran gas kutan sepenuhnya, yang paling terkenal adalah salamander plethodontid, yang tidak memiliki paru-paru maupun insang. Banyak salamander akuatik dan semua berudu memiliki insang pada tahap larva mereka, dengan beberapa spesies (seperti axolotl) mempertahankan insang saat dewasa di air.[77]
Reproduksi
[sunting | sunting sumber]
Untuk tujuan reproduksi, sebagian besar amfibi memerlukan air tawar meskipun beberapa meletakkan telurnya di darat dan telah mengembangkan berbagai cara untuk menjaga kelembapannya. Sedikit spesies (misalnya Fejervarya raja) dapat menghuni air payau, tetapi tidak ada amfibi laut sejati.[85] Namun, terdapat laporan mengenai populasi amfibi tertentu yang secara tak terduga menginvasi perairan laut. Hal demikian terjadi pada invasi Laut Hitam oleh hibrida alami Pelophylax esculentus yang dilaporkan pada tahun 2010.[86]
Akan tetapi, beberapa ratus spesies katak dalam radiasi adaptif (misalnya, Eleutherodactylus, Platymantis Pasifik, microhylid Australo-Papua, dan banyak katak tropis lainnya), tidak memerlukan air untuk berkembang biak di alam liar. Mereka bereproduksi melalui pengembangan langsung, sebuah adaptasi ekologis dan evolusioner yang memungkinkan mereka sepenuhnya independen dari genangan air. Hampir semua katak ini hidup di hutan hujan tropis basah dan telur mereka menetas langsung menjadi versi miniatur dari bentuk dewasa, melewati tahap berudu di dalam telur. Keberhasilan reproduksi banyak amfibi tidak hanya bergantung pada kuantitas curah hujan, tetapi juga waktu musiman.[87]
Di daerah tropis, banyak amfibi berkembang biak terus menerus atau kapan saja sepanjang tahun. Di daerah beriklim sedang, perkembangbiakan sebagian besar bersifat musiman, biasanya pada musim semi, dan dipicu oleh bertambahnya panjang hari, naiknya suhu, atau curah hujan. Eksperimen telah menunjukkan pentingnya suhu, tetapi peristiwa pemicunya, terutama di daerah kering, sering kali adalah badai. Pada anura, pejantan biasanya tiba di lokasi pembiakan sebelum betina dan paduan suara yang mereka hasilkan dapat merangsang ovulasi pada betina serta aktivitas endokrin pejantan yang belum aktif secara reproduktif.[88]
Pada sesilia, pembuahan terjadi secara internal, pejantan menjulurkan organ intromittent, phallodeum, dan memasukannya ke dalam kloaka betina. Kelenjar Müllerian berpasangan di dalam kloaka pejantan mengeluarkan cairan yang menyerupai yang diproduksi oleh kelenjar prostat mamalia dan yang mungkin mengangkut dan memberi nutrisi pada sperma. Pembuahan mungkin terjadi di dalam oviduk.[89]
Mayoritas salamander juga melakukan pembuahan internal. Pada sebagian besar salamander, pejantan menempatkan spermatofora, paket kecil sperma di atas kerucut gelatin, pada substrat baik di darat maupun di air. Betina mengambil paket sperma tersebut dengan mencengkeramnya menggunakan bibir kloaka dan mendorongnya ke dalam lubang kloaka. Spermatozoa bergerak ke spermateka di atap kloaka tempat mereka tinggal sampai ovulasi yang mungkin terjadi berbulan-bulan kemudian. Ritual pacaran dan metode pemindahan spermatofora bervariasi antar spesies. Pada beberapa spesies, spermatofora mungkin ditempatkan langsung ke dalam kloaka betina sementara pada spesies lain, betina mungkin dipandu ke spermatofora atau ditahan dengan pelukan yang disebut ampleksus. Salamander primitif tertentu dalam famili Sirenidae, Hynobiidae, dan Cryptobranchidae mempraktikkan pembuahan eksternal dengan cara yang mirip dengan katak, di mana betina meletakkan telur di air dan pejantan melepaskan sperma ke massa telur tersebut.[89]
Dengan sedikit pengecualian, katak menggunakan pembuahan eksternal. Pejantan mencengkeram betina dengan erat menggunakan tungkai depannya baik di belakang lengan atau di depan kaki belakang, atau dalam kasus Epipedobates tricolor, di sekitar leher. Mereka tetap dalam posisi ampleksus dengan kloaka mereka diposisikan berdekatan sementara betina meletakkan telur dan pejantan menutupinya dengan sperma. Bantalan kawin yang kasar pada tangan pejantan membantu mempertahankan cengkeraman. Sering kali pejantan mengumpulkan dan menahan massa telur, membentuk semacam keranjang dengan kaki belakangnya. Pengecualian adalah pada katak racun granular (Oophaga granulifera) di mana pejantan dan betina menempatkan kloaka mereka berdekatan sambil menghadap ke arah yang berlawanan dan kemudian melepaskan telur dan sperma secara bersamaan. Katak berekor (Ascaphus truei) menunjukkan pembuahan internal. "Ekor" hanya dimiliki oleh pejantan dan merupakan perpanjangan dari kloaka yang digunakan untuk menginseminasi betina. Katak ini hidup di aliran sungai yang deras dan pembuahan internal mencegah sperma hanyut sebelum pembuahan terjadi.[90] Sperma dapat ditahan dalam tabung penyimpanan yang melekat pada oviduk hingga musim semi berikutnya.[91]
Sebagian besar katak dapat diklasifikasikan sebagai pembiak berkepanjangan (prolonged breeders) atau pembiak eksplosif (explosive breeders). Biasanya, pembiak berkepanjangan berkumpul di lokasi pembiakan, dengan pejantan biasanya tiba lebih dulu, memanggil dan menetapkan wilayah kekuasaan. Pejantan satelit lainnya tetap diam di dekatnya, menunggu kesempatan untuk mengambil alih wilayah. Betina tiba secara sporadis, seleksi pasangan terjadi dan telur diletakkan. Betina pergi dan wilayah kekuasaan mungkin berpindah tangan. Lebih banyak betina muncul dan pada waktunya, musim kawin berakhir. Sebaliknya, pembiak eksplosif ditemukan di mana kolam sementara muncul di daerah kering setelah curah hujan. Katak-katak ini biasanya adalah spesies fosorial yang muncul setelah hujan lebat dan berkumpul di lokasi pembiakan. Mereka tertarik ke sana oleh panggilan pejantan pertama yang menemukan tempat yang cocok, mungkin sebuah kolam yang terbentuk di tempat yang sama setiap musim hujan. Katak-katak yang berkumpul mungkin memanggil serempak dan aktivitas yang sangat panik terjadi, para pejantan berebut untuk kawin dengan jumlah betina yang biasanya lebih sedikit.[90]

Terdapat kompetisi langsung antara pejantan untuk memenangkan perhatian betina pada salamander dan newt, dengan tampilan pacaran yang rumit untuk menjaga perhatian betina cukup lama agar dia tertarik memilih pejantan tersebut untuk kawin.[92] Beberapa spesies menyimpan sperma melalui musim kawin yang panjang, karena waktu ekstra tersebut memungkinkan interaksi dengan sperma saingan.[93]
Reproduksi uniseksual
[sunting | sunting sumber]Salamander mole betina uniseksual (genus Ambystoma) umum ditemukan di wilayah Great Lakes di Amerika Utara.[94] Salamander ini adalah garis keturunan vertebrata uniseksual tertua yang diketahui, yang muncul sekitar 5 juta tahun yang lalu.[95] Pertukaran genom terkadang dapat terjadi antara Ambystoma betina uniseksual dan pejantan dari spesies seksual simpatrik.[95]
Siklus hidup
[sunting | sunting sumber]Sebagian besar amfibi mengalami metamorfosis, suatu proses perubahan morfologis yang signifikan setelah kelahiran. Dalam perkembangan amfibi yang umum, telur diletakkan di air dan larva beradaptasi dengan gaya hidup akuatik. Katak, kodok, dan salamander semuanya menetas dari telur sebagai larva dengan insang eksternal. Metamorfosis pada amfibi diatur oleh konsentrasi tiroksin dalam darah, yang merangsang metamorfosis, dan prolaktin, yang menangkal efek tiroksin. Peristiwa spesifik bergantung pada nilai ambang batas untuk jaringan yang berbeda.[96] Karena sebagian besar perkembangan embrio terjadi di luar tubuh induk, hal ini tunduk pada banyak adaptasi akibat keadaan lingkungan yang spesifik. Karena alasan ini, berudu dapat memiliki gigir tanduk alih-alih gigi, ekstensi kulit menyerupai kumis, atau sirip. Mereka juga memanfaatkan organ indra garis rusuk yang mirip dengan milik ikan. Setelah metamorfosis, organ-organ ini menjadi berlebihan dan akan diserap kembali melalui kematian sel terkontrol, yang disebut apoptosis. Variasi adaptasi terhadap keadaan lingkungan spesifik di antara amfibi sangat luas, dengan banyak penemuan yang masih terus dilakukan.[97]
Telur
[sunting | sunting sumber]

- Kapsul jeli
- Membran vitelin
- Cairan perivitelin
- Sumbat kuning telur
- Embrio
Di dalam telur, embrio tersuspensi dalam cairan perivitelin dan dikelilingi oleh kapsul gelatin semi-permeabel, dengan massa kuning telur menyediakan nutrisi. Saat larva menetas, kapsul dilarutkan oleh enzim yang disekresikan dari kelenjar di ujung moncong.[76] Telur beberapa salamander dan katak mengandung alga hijau bersel tunggal. Alga ini menembus selubung jeli setelah telur diletakkan dan dapat meningkatkan pasokan oksigen ke embrio melalui fotosintesis. Mereka tampaknya mempercepat perkembangan larva sekaligus mengurangi kematian.[98] Pada katak kayu (Rana sylvatica), bagian dalam kelompok telur bundar ditemukan memiliki suhu hingga 6 °C (11 °F) lebih hangat daripada lingkungan sekitarnya, yang merupakan keuntungan di habitat utaranya yang dingin.[99]
Telur dapat diletakkan satu per satu, dalam kelompok, atau dalam untaian panjang. Lokasi peletakan telur meliputi air, lumpur, liang, serasah, dan pada tanaman atau di bawah kayu gelondongan atau batu.[100] Katak rumah kaca (Eleutherodactylus planirostris) meletakkan telur dalam kelompok kecil di tanah di mana mereka berkembang dalam waktu sekitar dua minggu langsung menjadi katak muda tanpa melewati tahap larva.[101] Katak tungara (Physalaemus pustulosus) membangun sarang terapung dari busa untuk melindungi telurnya. Pertama-tama rakit dibangun, kemudian telur diletakkan di tengah, dan akhirnya tutup busa diletakkan di atasnya. Busa tersebut memiliki sifat antimikroba. Ia tidak mengandung deterjen tetapi dibuat dengan mengocok protein dan lektin yang disekresikan oleh betina.[102][103]
Larva
[sunting | sunting sumber]
Telur amfibi biasanya diletakkan di air dan menetas menjadi larva yang hidup bebas yang menyelesaikan perkembangannya di air dan kemudian berubah menjadi bentuk dewasa yang bersifat akuatik atau terestrial. Pada banyak spesies katak dan pada sebagian besar salamander tanpa paru-paru (Plethodontidae), terjadi pengembangan langsung, di mana larva tumbuh di dalam telur dan muncul sebagai bentuk dewasa mini. Banyak sesilia dan beberapa amfibi lainnya meletakkan telur mereka di darat, dan larva yang baru menetas menggeliat atau diangkut ke badan air. Beberapa sesilia, salamander alpen (Salamandra atra), dan beberapa kodok Afrika yang melahirkan (Nectophrynoides spp.) bersifat vivipar. Larva mereka memakan sekresi kelenjar dan berkembang di dalam oviduk betina, sering kali dalam waktu yang lama. Amfibi lain, tetapi bukan sesilia, bersifat ovovivipar. Telur disimpan di dalam atau di tubuh induknya, tetapi larva hidup dari kuning telur telurnya dan tidak menerima nutrisi dari induknya. Larva muncul pada berbagai tahap pertumbuhannya, baik sebelum atau sesudah metamorfosis, sesuai dengan spesiesnya.[104] Genus kodok Nectophrynoides menunjukkan semua pola perkembangan ini di antara belasan anggotanya.[13] Larva amfibi dikenal sebagai berudu. Mereka memiliki tubuh bulat dan tebal dengan ekor berotot yang kuat.[79]
Katak
[sunting | sunting sumber]Berbeda dengan pada amfibi lainnya, berudu katak tidak menyerupai bentuk dewasanya.[105] Larva yang hidup bebas biasanya sepenuhnya akuatik, tetapi berudu dari beberapa spesies (seperti Nannophrys ceylonensis) bersifat semi-terestrial dan hidup di antara bebatuan basah.[106] Berudu memiliki kerangka bertulang rawan, insang untuk respirasi (awalnya insang eksternal, kemudian insang internal), sistem garis rusuk, dan ekor besar yang mereka gunakan untuk berenang.[107] Berudu yang baru menetas segera mengembangkan kantung insang yang menutupi insang. Insang internal dan operkulum ini tidak homolog dengan milik ikan,[108] dan hanya ditemukan pada berudu karena salamander maupun sesilia hanya memiliki insang eksternal.[109] Dikombinasikan dengan pemompaan bukal, insang internal memungkinkan berudu untuk mengadopsi gaya hidup makan dengan menyaring, meskipun beberapa spesies telah mengembangkan strategi makan jenis lain.[110] Paru-paru berkembang sejak dini dan digunakan sebagai organ pernapasan tambahan, di mana berudu naik ke permukaan air untuk meneguk udara. Beberapa spesies menyelesaikan perkembangannya di dalam telur dan menetas langsung menjadi katak kecil. Larva ini tidak memiliki insang, melainkan memiliki area kulit khusus tempat respirasi berlangsung. Meskipun berudu tidak memiliki gigi sejati, pada sebagian besar spesies, rahangnya memiliki barisan panjang paralel dari struktur berkeratin kecil yang disebut keradont yang dikelilingi oleh paruh tanduk.[111] Kaki depan terbentuk di bawah kantung insang dan kaki belakang menjadi terlihat beberapa hari kemudian.
Iodine dan T4 (merangsang secara berlebihan apoptosis [kematian sel terprogram] spektakuler pada sel-sel insang larva, ekor, dan sirip) juga merangsang evolusi sistem saraf yang mengubah berudu vegetarian akuatik menjadi katak karnivora terestrial dengan kemampuan neurologis, visuospasial, olfaktori, dan kognitif yang lebih baik untuk berburu.[112][113]
Faktanya, berudu yang berkembang di kolam dan aliran sungai biasanya bersifat herbivora. Berudu kolam cenderung memiliki tubuh yang dalam (lebar vertikal), sirip kaudal yang besar, dan mulut yang kecil; mereka berenang di perairan tenang memakan serpihan vegetasi yang tumbuh atau lepas. Penghuni aliran sungai sebagian besar memiliki mulut yang lebih besar, tubuh dan sirip kaudal yang dangkal (pipih); mereka menempelkan diri pada tanaman dan batu serta memakan lapisan tipis alga dan bakteri di permukaan.[114] Mereka juga memakan diatom, yang disaring dari air melalui insang, dan mengaduk sedimen di dasar kolam, menelan fragmen yang dapat dimakan. Mereka memiliki usus yang relatif panjang dan berbentuk spiral untuk memungkinkan mereka mencerna makanan ini.[114] Beberapa spesies bersifat karnivora pada tahap berudu, memakan serangga, berudu yang lebih kecil, dan ikan. Anak-anak katak pohon Kuba (Osteopilus septentrionalis) terkadang bisa bersifat kanibal, di mana berudu yang lebih muda menyerang berudu yang lebih besar dan lebih berkembang saat sedang mengalami metamorfosis.[115]
Pada saat metamorfosis, perubahan cepat pada tubuh terjadi seiring berubahnya gaya hidup katak secara total. Mulut berbentuk spiral dengan gigir gigi tanduk diserap kembali bersamaan dengan usus spiral. Hewan tersebut mengembangkan rahang yang besar, dan insangnya menghilang bersama dengan kantung insangnya. Mata dan kaki tumbuh dengan cepat, dan lidah pun terbentuk. Terdapat perubahan terkait dalam jaringan saraf seperti pengembangan penglihatan stereoskopis dan hilangnya sistem garis rusuk. Semua ini bisa terjadi dalam waktu sekitar satu hari. Beberapa hari kemudian, ekor diserap kembali, karena konsentrasi tiroksin yang lebih tinggi diperlukan agar hal ini terjadi.[114]
Salamander
[sunting | sunting sumber]
(Ambystoma macrodactylum)

(Ambystoma macrodactylum)

(Ichthyosaura alpestris)
Saat menetas, larva salamander yang khas memiliki mata tanpa kelopak, gigi di rahang atas dan bawah, tiga pasang insang eksternal berbulu, dan ekor panjang dengan sirip dorsal dan ventral. Tungkai depan mungkin berkembang sebagian dan tungkai belakang bersifat rudimenter pada spesies yang hidup di kolam, tetapi mungkin agak lebih berkembang pada spesies yang bereproduksi di air mengalir. Larva tipe kolam sering memiliki sepasang penyeimbang (balancers), struktur seperti batang di kedua sisi kepala yang dapat mencegah insang tersumbat oleh sedimen.[116][117] Keduanya mampu berkembang biak.[118] Beberapa memiliki larva yang tidak pernah berkembang sepenuhnya menjadi bentuk dewasa, suatu kondisi yang dikenal sebagai neoteni.[119] Neoteni terjadi ketika laju pertumbuhan hewan sangat rendah dan biasanya dikaitkan dengan kondisi buruk seperti suhu air yang rendah yang dapat mengubah respons jaringan terhadap hormon tiroksin[120] serta kekurangan makanan. Terdapat lima belas spesies salamander neotenik obligat, termasuk spesies Necturus, Proteus, dan Amphiuma, serta banyak contoh spesies fakultatif, seperti salamander barat laut (Ambystoma gracile) dan salamander harimau (A. tigrinum) yang mengadopsi strategi ini dalam keadaan lingkungan yang sesuai.[119]
Salamander tanpa paru-paru dalam famili Plethodontidae bersifat terestrial dan meletakkan sejumlah kecil telur tidak berpigmen dalam satu gugusan di antara serasah daun yang lembap. Setiap telur memiliki kantung kuning telur yang besar dan larva memakan ini saat berkembang di dalam telur, muncul sepenuhnya terbentuk sebagai salamander muda. Salamander betina sering mengerami telur-telurnya. Dalam genus Ensatinas, betina telah diamati melingkar di sekeliling telur dan menekan area tenggorokannya ke arah telur-telur tersebut, secara efektif memijatnya dengan sekresi mukosa.[121]
Pada newt dan salamander, metamorfosis tidak sedramatis pada katak. Hal ini karena larva sudah bersifat karnivora dan terus makan sebagai predator saat dewasa sehingga hanya sedikit perubahan yang diperlukan pada sistem pencernaan mereka. Paru-paru mereka berfungsi sejak dini, tetapi larva tidak terlalu memanfaatkannya sebanyak berudu. Insang mereka tidak pernah tertutup oleh kantung insang dan diserap kembali tepat sebelum hewan meninggalkan air. Perubahan lain meliputi pengurangan ukuran atau hilangnya sirip ekor, penutupan celah insang, penebalan kulit, perkembangan kelopak mata, dan perubahan tertentu pada susunan gigi dan struktur lidah. Salamander berada pada kondisi paling rentan saat metamorfosis karena kecepatan berenang berkurang dan ekor yang sedang berubah menjadi beban di darat.[122] Salamander dewasa sering kali memiliki fase akuatik di musim semi dan musim panas, serta fase darat di musim dingin. Untuk adaptasi ke fase air, prolaktin adalah hormon yang diperlukan, dan untuk adaptasi ke fase darat, tiroksin. Insang eksternal tidak tumbuh kembali pada fase akuatik berikutnya karena insang tersebut terserap sepenuhnya saat meninggalkan air untuk pertama kalinya.[116]
Sesilia
[sunting | sunting sumber]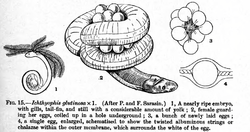
Sebagian besar sesilia terestrial yang bertelur meletakkan telurnya di dalam liang atau tempat lembap di darat dekat badan air. Perkembangan anak Ichthyophis glutinosus, spesies dari Sri Lanka, telah banyak dipelajari. Larva yang menyerupai belut menetas dari telur dan menuju ke air. Mereka memiliki tiga pasang insang eksternal berwarna merah seperti bulu, kepala tumpul dengan dua mata rudimenter, sistem garis rusuk, dan ekor pendek bersirip. Mereka berenang dengan menggelombangkan tubuh mereka dari sisi ke sisi. Mereka sebagian besar aktif di malam hari, segera kehilangan insang, dan mulai merambah ke daratan. Metamorfosis berlangsung secara bertahap. Pada usia sekitar sepuluh bulan, mereka telah mengembangkan kepala runcing dengan tentakel sensorik di dekat mulut dan kehilangan mata, sistem garis rusuk, serta ekor. Kulit menebal, sisik yang tertanam berkembang, dan tubuh terbagi menjadi segmen-segmen. Pada saat ini, sesilia telah membangun liang dan hidup di darat.[123]

Pada mayoritas spesies sesilia, anak dihasilkan melalui viviparitas. Typhlonectes compressicauda, spesies dari Amerika Selatan, adalah contoh khas dari kelompok ini. Hingga sembilan larva dapat berkembang di dalam oviduk pada satu waktu. Mereka memanjang dan memiliki insang berpasangan seperti kantung, mata kecil, dan gigi pengikis khusus. Pada awalnya, mereka memakan kuning telur, tetapi seiring menipisnya sumber nutrisi ini, mereka mulai mengikis sel epitel bersilia yang melapisi oviduk. Hal ini merangsang sekresi cairan yang kaya akan lipid dan mukoprotein yang mereka makan bersama dengan kikisan dinding oviduk. Panjang mereka dapat meningkat enam kali lipat dan mencapai dua perlima panjang induknya sebelum dilahirkan. Pada saat itu mereka telah mengalami metamorfosis, kehilangan mata dan insang, mengembangkan kulit yang lebih tebal dan tentakel mulut, serta menyerap kembali gigi mereka. Serangkaian gigi permanen tumbuh segera setelah lahir.[124][125]
Insang hanya diperlukan selama perkembangan embrio, dan pada spesies yang melahirkan, keturunannya lahir setelah degenerasi insang. Pada sesilia yang bertelur, insang diserap kembali sebelum menetas, atau, pada spesies yang menetas dengan sisa insang yang masih ada, insang tersebut berumur pendek dan hanya menyisakan celah insang. Bagi spesies dengan sisik di bawah kulit, sisik tersebut tidak terbentuk sebelum metamorfosis berlangsung.[126]
Sesilia cincin (Siphonops annulatus) telah mengembangkan adaptasi unik untuk tujuan reproduksi. Keturunannya memakan lapisan kulit yang dikembangkan secara khusus oleh induk dewasa dalam fenomena yang dikenal sebagai dermatofagi maternal. Anak-anak tersebut makan secara berkelompok selama sekitar tujuh menit dengan interval sekitar tiga hari, yang memberi kesempatan bagi kulit induk untuk beregenerasi. Sementara itu, mereka juga diamati menelan cairan yang dikeluarkan dari kloaka induk.[127]
Pengasuhan induk
[sunting | sunting sumber]
Pengasuhan keturunan di kalangan amfibi masih sedikit dipelajari, tetapi, secara umum, semakin besar jumlah telur dalam satu kelompok, semakin kecil kemungkinan terjadinya pengasuhan induk. Meskipun demikian, diperkirakan bahwa hingga 20% spesies amfibi, salah satu atau kedua induk memainkan peran tertentu dalam perawatan anak.[128] Spesies yang berkembang biak di badan air yang lebih kecil atau habitat khusus lainnya cenderung memiliki pola perilaku yang kompleks dalam perawatan anak mereka.[129]
Banyak salamander hutan meletakkan sekelompok telur di bawah kayu mati atau batu di darat. Salamander gunung hitam (Desmognathus welteri) melakukan hal ini, di mana sang induk mengerami telur dan menjaganya dari pemangsaan saat embrio memakan kuning telur telurnya. Ketika berkembang sepenuhnya, mereka memecahkan kapsul telur dan menyebar sebagai salamander muda.[130] Hellbender jantan, salamander primitif, menggali sarang di bawah air dan mendorong betina untuk bertelur di sana. Pejantan kemudian menjaga lokasi tersebut selama dua atau tiga bulan sebelum telur menetas, menggunakan gerakan tubuh untuk mengipasi telur dan meningkatkan pasokan oksigennya.[58]

Pejantan Colostethus subpunctatus, sejenis katak kecil, melindungi kelompok telur yang tersembunyi di bawah batu atau kayu gelondongan. Ketika telur menetas, pejantan mengangkut berudu di punggungnya, yang menempel di sana oleh sekresi mukosa, ke kolam sementara di mana ia mencelupkan dirinya ke dalam air dan berudu pun lepas.[131] Pejantan kodok bidan (Alytes obstetricans) melilitkan untaian telur di sekitar pahanya dan membawa telur-telur tersebut selama hingga delapan minggu. Ia menjaganya tetap lembap dan ketika siap menetas, ia mengunjungi kolam atau parit dan melepaskan berudu.[132] Betina katak pengeram lambung (Rheobatrachus spp.) membesarkan larva di dalam perutnya setelah menelan telur atau anak yang baru menetas; namun, tahap ini tidak pernah diamati sebelum spesies tersebut punah. Berudu mengeluarkan hormon yang menghambat pencernaan pada induk sementara mereka berkembang dengan mengonsumsi persediaan kuning telur mereka yang sangat besar.[133] Katak berkantung (Assa darlingtoni) meletakkan telur di tanah. Ketika menetas, pejantan membawa berudu berkeliling dalam kantung pengeraman di kaki belakangnya.[134] Kodok Suriname yang akuatik (Pipa pipa) membesarkan anak-anaknya di dalam pori-pori di punggungnya di mana mereka tetap tinggal hingga metamorfosis.[135] Katak racun granular (Oophaga granulifera) adalah ciri khas dari sejumlah katak pohon dalam famili katak panah beracun Dendrobatidae. Telurnya diletakkan di lantai hutan dan ketika menetas, berudu dibawa satu per satu di punggung induk dewasa ke celah berisi air yang sesuai seperti ketiak daun atau roset dari bromelia. Betina mengunjungi lokasi pembesaran secara teratur dan meletakkan telur yang tidak dibuahi di dalam air dan telur-telur ini dikonsumsi oleh berudu.[136]
Genetika dan genomika
[sunting | sunting sumber]Amfibi menonjol di antara vertebrata karena keragaman kromosom dan genomnya. Kariotipe (kromosom) telah ditentukan untuk setidaknya 1.193 (14,5%) dari ≈8.200 spesies (diploid) yang diketahui, termasuk 963 anura, 209 salamander, dan 21 sesilia. Umumnya, kariotipe amfibi diploid dicirikan oleh 20–26 kromosom berlengan dua. Amfibi juga memiliki genom yang sangat besar dibandingkan dengan taksa vertebrata lainnya dan variasi yang sesuai dalam ukuran genom (nilai C: pikogram DNA dalam inti haploid). Ukuran genom berkisar antara 0,95 hingga 11,5 pg pada katak, dari 13,89 hingga 120,56 pg pada salamander, dan dari 2,94 hingga 11,78 pg pada sesilia.[137]
Ukuran genom yang besar telah menghambat pengurutan seluruh genom amfibi meskipun sejumlah genom telah dipublikasikan baru-baru ini. Draf genom 1,7GB milik Katak cakar barat adalah yang pertama dilaporkan untuk amfibi pada tahun 2010.[137] Dibandingkan dengan beberapa salamander, genom katak ini sangat kecil. Misalnya, genom axolotl Meksiko ternyata sebesar 32 Gb, yang lebih dari 10 kali lebih besar daripada genom manusia (3GB).[138]
Makan dan diet
[sunting | sunting sumber]
(Ambystoma gracile) sedang memakan cacing
Dengan sedikit pengecualian, amfibi dewasa adalah predator, yang memakan hampir apa saja yang bergerak yang dapat mereka telan. Makanannya sebagian besar terdiri dari mangsa kecil yang tidak bergerak terlalu cepat seperti kumbang, ulat, cacing tanah, dan laba-laba. Siren (Siren spp.) sering menelan materi tumbuhan air bersama invertebrata yang mereka makan[139] dan seekor katak pohon Brasil (Xenohyla truncata) memasukkan sejumlah besar buah dalam makanannya.[140] Kodok penggali Meksiko (Rhinophrynus dorsalis) memiliki lidah yang beradaptasi khusus untuk mengambil semut dan rayap. Ia menjulurkan lidahnya dengan bagian ujung terlebih dahulu, sedangkan katak lain menjentikkan bagian belakang terlebih dahulu, karena lidah mereka engselnya berada di depan.[141]
Makanan sebagian besar dipilih melalui penglihatan, bahkan dalam kondisi cahaya redup. Gerakan mangsa memicu respons makan. Katak pernah tertangkap kail pancing yang diberi umpan kain flanel merah dan katak hijau (Rana clamitans) ditemukan dengan perut penuh biji elm yang mereka lihat hanyut melewatinya.[142] Kodok, salamander, dan sesilia juga menggunakan penciuman untuk mendeteksi mangsa. Respons ini sebagian besar bersifat sekunder karena salamander telah diamati tetap diam di dekat mangsa yang berbau namun hanya makan jika mangsa tersebut bergerak. Amfibi penghuni gua biasanya berburu dengan penciuman. Beberapa salamander tampaknya telah belajar mengenali mangsa yang tidak bergerak ketika mangsa tersebut tidak berbau, bahkan dalam kegelapan total.[143]
Amfibi biasanya menelan makanan secara utuh tetapi mungkin mengunyahnya sedikit terlebih dahulu untuk melumpuhkannya.[47] Mereka biasanya memiliki gigi pediselata berengsel kecil, fitur yang unik bagi amfibi. Bagian dasar dan mahkota gigi ini terdiri dari dentin yang dipisahkan oleh lapisan yang tidak mengalami kalsifikasi dan diganti secara berkala. Salamander, sesilia, dan beberapa katak memiliki satu atau dua baris gigi di kedua rahang, tetapi beberapa katak (Rana spp.) tidak memiliki gigi di rahang bawah, dan kodok (Bufo spp.) tidak memiliki gigi sama sekali. Pada banyak amfibi, terdapat juga gigi vomerin yang melekat pada tulang wajah di langit-langit mulut.[144]

Salamander harimau (Ambystoma tigrinum) adalah ciri khas dari katak dan salamander yang bersembunyi di bawah penutup siap untuk menyergap invertebrata yang lengah. Amfibi lain, seperti kodok Bufo spp., secara aktif mencari mangsa, sementara katak bertanduk Argentina (Ceratophrys ornata) memikat mangsa yang penasaran agar mendekat dengan mengangkat kaki belakangnya ke atas punggung dan menggetarkan jari-jari kakinya yang berwarna kuning.[145] Di antara katak serasah daun di Panama, katak yang aktif berburu mangsa memiliki mulut sempit dan bertubuh ramping, sering kali berwarna cerah dan beracun, sementara penyergap memiliki mulut lebar serta bertubuh lebar dan tersamar dengan baik.[146] Sesilia tidak menjentikkan lidah mereka, tetapi menangkap mangsanya dengan mencengkeramnya menggunakan gigi yang sedikit mengarah ke belakang. Perlawanan mangsa dan gerakan rahang lebih lanjut memindahkan mangsa ke dalam dan sesilia biasanya mundur ke dalam liangnya. Mangsa yang telah dilumpuhkan ditelan bulat-bulat.[147]
Ketika baru menetas, larva katak memakan kuning telur. Ketika ini habis, beberapa beralih memakan bakteri, kerak alga, detritus, dan kikisan dari tanaman yang terendam air. Air ditarik masuk melalui mulut mereka, yang biasanya berada di bagian bawah kepala, dan melewati perangkap makanan brankial di antara mulut dan insang mereka di mana partikel-partikel halus terperangkap dalam lendir dan disaring. Lainnya memiliki bagian mulut khusus yang terdiri dari paruh tanduk yang dibatasi oleh beberapa baris gigi labial. Mereka mengikis dan menggigit berbagai jenis makanan serta mengaduk sedimen dasar, menyaring partikel yang lebih besar dengan papila di sekitar mulut mereka. Beberapa, seperti kodok spadefoot, memiliki rahang penggigit yang kuat dan bersifat karnivora atau bahkan kanibal.[148]
Vokalisasi
[sunting | sunting sumber]
Panggilan yang dibuat oleh sesilia dan salamander terbatas pada cicitan lirih, dengusan, atau desisan yang sesekali dan belum banyak dipelajari. Suara klik yang terkadang dihasilkan oleh sesilia mungkin merupakan sarana orientasi, seperti pada kelelawar, atau bentuk komunikasi. Sebagian besar salamander dianggap tidak bersuara, tetapi salamander raksasa California (Dicamptodon ensatus) memiliki pita suara dan dapat menghasilkan suara gemerincing atau gonggongan. Beberapa spesies salamander mengeluarkan cicitan atau lengkingan pelan jika diserang.[149]

Katak jauh lebih vokal, terutama selama musim kawin ketika mereka menggunakan suara mereka untuk memikat pasangan. Kehadiran spesies tertentu di suatu area mungkin lebih mudah dikenali dari panggilan khasnya daripada melihat sekilas hewan itu sendiri. Pada sebagian besar spesies, suara dihasilkan dengan mengeluarkan udara dari paru-paru melewati pita suara ke dalam satu atau lebih kantung suara di tenggorokan atau di sudut mulut. Kantung ini dapat menggelembung seperti balon dan bertindak sebagai resonator, membantu mentransfer suara ke atmosfer, atau ke air pada saat hewan tersebut terendam.[149] Vokalisasi utamanya adalah panggilan iklan pejantan yang keras yang bertujuan untuk mendorong betina mendekat sekaligus mencegah pejantan lain mengganggu wilayahnya. Panggilan ini dimodifikasi menjadi panggilan pacaran yang lebih pelan saat betina mendekat atau menjadi versi yang lebih agresif jika pengganggu jantan mendekat. Memanggil membawa risiko menarik perhatian predator dan melibatkan pengeluaran banyak energi.[150] Panggilan lain termasuk yang diberikan oleh betina sebagai tanggapan terhadap panggilan iklan dan panggilan pelepasan yang diberikan oleh jantan atau betina selama upaya ampleksus yang tidak diinginkan. Ketika seekor katak diserang, panggilan tanda bahaya atau ketakutan dikeluarkan, sering kali menyerupai jeritan.[151] Katak pohon Kuba (Osteopilus septentrionalis) yang biasanya nokturnal menghasilkan panggilan hujan ketika terjadi curah hujan pada siang hari.[152]
Perilaku teritorial
[sunting | sunting sumber]Sedikit yang diketahui tentang perilaku teritorial sesilia, tetapi beberapa katak dan salamander mempertahankan daerah jelajah (home range). Ini biasanya merupakan lokasi makan, berkembang biak, atau berlindung. Pejantan biasanya menunjukkan perilaku seperti itu meskipun pada beberapa spesies, betina dan bahkan hewan muda juga terlibat. Meskipun pada banyak spesies katak, betina lebih besar daripada pejantan, hal ini tidak terjadi pada sebagian besar spesies di mana pejantan terlibat aktif dalam pertahanan teritorial. Beberapa di antaranya memiliki adaptasi khusus seperti gigi yang membesar untuk menggigit atau duri di dada, lengan, atau ibu jari.[153]

Pada salamander, pertahanan wilayah melibatkan pengambilan postur agresif dan jika perlu menyerang penyusup. Ini mungkin melibatkan gerakan menyentak (snapping), mengejar, dan terkadang menggigit, yang kadang-kadang menyebabkan hilangnya ekor. Perilaku salamander punggung merah (Plethodon cinereus) telah banyak dipelajari. 91% individu yang ditandai dan kemudian ditangkap kembali berada dalam jarak satu meter dari tempat persembunyian siang hari asli mereka di bawah kayu atau batu.[154] Proporsi yang sama, ketika dipindahkan secara eksperimental sejauh 30 meter (98 ft), menemukan jalan kembali ke pangkalan rumah mereka.[154] Salamander meninggalkan tanda bau di sekitar wilayah mereka yang rata-rata berukuran 016 hingga 033 meter persegi (170 hingga 360 sq ft) dan terkadang dihuni oleh pasangan jantan dan betina.[155] Ini menghalangi gangguan dari individu lain dan membatasi batas antara area tetangga. Sebagian besar perilaku mereka tampak stereotip dan tidak melibatkan kontak fisik yang sebenarnya antar individu. Postur agresif melibatkan mengangkat tubuh dari tanah dan menatap lawan yang sering kali berpaling dengan patuh. Jika penyusup bersikeras, serangan gigitan biasanya diluncurkan baik ke wilayah ekor atau alur naso-labial. Kerusakan pada salah satu area ini dapat mengurangi kebugaran saingan, baik karena kebutuhan untuk meregenerasi jaringan atau karena merusak kemampuannya untuk mendeteksi makanan.[154]
Pada katak, perilaku teritorial jantan sering diamati di lokasi pembiakan; panggilan merupakan pengumuman kepemilikan bagian dari sumber daya ini sekaligus panggilan iklan bagi calon pasangan. Secara umum, suara yang lebih dalam mewakili individu yang lebih berat dan lebih kuat, dan ini mungkin cukup untuk mencegah gangguan oleh pejantan yang lebih kecil. Banyak energi digunakan dalam vokalisasi dan ini membebani pemegang wilayah yang mungkin digantikan oleh saingan yang lebih bugar jika ia lelah. Ada kecenderungan bagi pejantan untuk menoleransi pemegang wilayah tetangga sambil menyerang penyusup tak dikenal dengan penuh semangat. Pemegang wilayah memiliki "keuntungan tuan rumah" dan biasanya bernasib lebih baik dalam pertemuan antara dua katak berukuran sama. Jika ancaman tidak cukup, pergulatan dada ke dada dapat terjadi. Metode perkelahian meliputi dorong-mendorong, mengempiskan kantung suara lawan, mencengkeram kepalanya, melompat ke punggungnya, menggigit, mengejar, memercikkan air, dan membenamkannya ke dalam air.[156]
Mekanisme pertahanan
[sunting | sunting sumber]
Amfibi memiliki tubuh lunak dengan kulit tipis, serta tidak memiliki cakar, pelindung pertahanan, atau duri. Meskipun demikian, mereka telah mengembangkan berbagai mekanisme pertahanan untuk menjaga kelangsungan hidup mereka. Garis pertahanan pertama pada salamander dan katak adalah sekresi mukus yang mereka hasilkan. Ini menjaga kulit mereka tetap lembap dan membuat mereka licin serta sulit digenggam. Sekresi tersebut sering kali lengket dan terasa tidak enak atau beracun.[157] Ular telah diamati menguap dan menganga ketika mencoba menelan katak cakar Afrika (Xenopus laevis), yang memberikan kesempatan bagi katak tersebut untuk melarikan diri.[157][158] Sesilia belum banyak dipelajari dalam hal ini, tetapi sesilia Cayenne (Typhlonectes compressicauda) menghasilkan mukus beracun yang telah membunuh ikan predator dalam sebuah eksperimen pemberian makan di Brasil.[159] Pada beberapa salamander, kulitnya beracun. Newt kulit kasar (Taricha granulosa) dari Amerika Utara dan anggota lain dari genusnya mengandung neurotoksin tetrodotoksin (TTX), zat non-protein paling beracun yang diketahui dan hampir identik dengan yang diproduksi oleh ikan buntal. Memegang newt tersebut tidak membahayakan, tetapi menelan kulitnya dalam jumlah yang sangat sedikit sekalipun sangat mematikan. Dalam uji coba pemberian makan, ikan, katak, reptil, burung, dan mamalia semuanya ditemukan rentan.[160][161] Satu-satunya predator yang memiliki toleransi terhadap racun tersebut adalah populasi tertentu dari ular garter biasa (Thamnophis sirtalis). Di lokasi di mana ular dan salamander hidup berdampingan, ular telah mengembangkan kekebalan melalui perubahan genetik dan mereka memangsa amfibi tersebut tanpa dampak buruk.[162] Koevolusi terjadi dengan newt meningkatkan kemampuan toksiknya pada tingkat yang sama saat ular mengembangkan kekebalannya lebih lanjut.[161] Beberapa katak dan kodok beracun, dengan kelenjar racun utama berada di sisi leher dan di bawah kutil di punggung. Wilayah-wilayah ini diarahkan ke hewan penyerang dan sekresinya mungkin terasa tidak enak atau menyebabkan berbagai gejala fisik atau neurologis. Secara keseluruhan, lebih dari 200 racun telah diisolasi dari sejumlah terbatas spesies amfibi yang telah diteliti.[163]


Spesies beracun sering menggunakan pewarnaan cerah untuk memperingatkan calon predator akan toksisitas mereka. Warna-warna peringatan ini cenderung merah atau kuning yang dikombinasikan dengan hitam, dengan salamander api (Salamandra salamandra) sebagai contohnya. Setelah predator mencicipi salah satu dari hewan ini, ia kemungkinan akan mengingat pewarnaan tersebut saat berikutnya bertemu hewan serupa. Pada beberapa spesies, seperti kodok perut api (Bombina spp.), pewarnaan peringatan berada di perut dan hewan-hewan ini mengambil pose defensif saat diserang, memamerkan warna cerah mereka kepada predator. Katak Allobates zaparo tidak beracun, tetapi meniru penampilan spesies beracun lain di wilayahnya, sebuah strategi yang dapat menipu predator.[165]
Banyak amfibi bersifat nokturnal dan bersembunyi pada siang hari, sehingga menghindari predator diurnal yang berburu dengan penglihatan. Amfibi lain menggunakan kamuflase untuk menghindari deteksi. Mereka memiliki berbagai pewarnaan seperti cokelat berbintik, abu-abu, dan zaitun untuk menyatu dengan latar belakang. Beberapa salamander mengambil pose defensif ketika berhadapan dengan calon predator seperti celurut ekor pendek utara Amerika Utara (Blarina brevicauda). Tubuh mereka menggeliat dan mereka mengangkat serta mengibaskan ekor, yang menyulitkan predator untuk menghindari kontak dengan kelenjar granular penghasil racun mereka.[166] Beberapa salamander akan melakukan autotomi pada ekornya saat diserang, mengorbankan bagian anatomi ini agar mereka dapat melarikan diri. Ekor tersebut mungkin memiliki penyempitan di pangkalnya agar mudah lepas. Ekor tersebut beregenerasi kemudian, tetapi biaya energi bagi hewan untuk menggantinya sangat signifikan.[70] Beberapa katak dan kodok menggembungkan diri agar terlihat besar dan garang, dan beberapa kodok spadefoot (Pelobates spp) menjerit dan melompat ke arah penyerang.[47] Salamander raksasa dari genus Andrias, serta katak Ceratophryinae dan Pyxicephalus memiliki gigi tajam dan mampu melukai hingga berdarah dengan gigitan defensif. Salamander perut hitam (Desmognathus quadramaculatus) dapat menggigit ular garter biasa (Thamnophis sirtalis) penyerang yang berukuran dua atau tiga kali lipat darinya tepat di kepala dan sering kali berhasil melarikan diri.[167]
Kognisi
[sunting | sunting sumber]Pada amfibi, terdapat bukti adanya habituasi, pembelajaran asosiatif baik melalui pembelajaran klasik maupun instrumental, serta kemampuan diskriminasi.[168] Amfibi secara luas dianggap sebagai makhluk yang berperasaan, mampu merasakan emosi seperti kecemasan dan ketakutan.[169]
Dalam sebuah eksperimen, ketika ditawari lalat buah hidup (Drosophila virilis), salamander memilih jumlah yang lebih besar antara 1 vs 2 dan 2 vs 3. Katak dapat membedakan antara jumlah kecil (1 vs 2, 2 vs 3, tetapi tidak 3 vs 4) dan jumlah besar (3 vs 6, 4 vs 8, tetapi tidak 4 vs 6) mangsa. Hal ini terlepas dari karakteristik lain, yaitu luas permukaan, volume, berat, dan gerakan, meskipun diskriminasi di antara jumlah besar mungkin didasarkan pada luas permukaan.[170]
Konservasi
[sunting | sunting sumber]
Penurunan drastis populasi amfibi, termasuk keruntuhan populasi dan kepunahan massal lokal, telah dicatat sejak akhir 1980-an dari berbagai lokasi di seluruh dunia, dan penurunan amfibi dengan demikian dianggap sebagai salah satu ancaman paling kritis terhadap keanekaragaman hayati global.[171] Pada tahun 2004, Uni Internasional untuk Konservasi Alam (IUCN) melaporkan bahwa tingkat kepunahan burung,[172] mamalia, dan amfibi saat ini setidaknya 48 kali lebih besar daripada tingkat kepunahan alami—bahkan mungkin 1.024 kali lebih tinggi. Pada tahun 2006, diyakini terdapat 4.035 spesies amfibi yang bergantung pada air pada beberapa tahap selama siklus hidupnya. Dari jumlah tersebut, 1.356 (33,6%) dianggap terancam dan angka ini kemungkinan merupakan perkiraan yang terlalu rendah karena tidak termasuk 1.427 spesies yang datanya tidak cukup untuk menilai statusnya.[173] Sejumlah penyebab diyakini terlibat, termasuk perusakan habitat dan modifikasi, eksploitasi berlebihan, polusi, spesies pendatang, pemanasan global, polutan pengganggu endokrin, kerusakan lapisan ozon (radiasi ultraviolet telah terbukti sangat merusak kulit, mata, dan telur amfibi), serta penyakit seperti kitridiomikosis. Namun, banyak penyebab penurunan amfibi masih kurang dipahami, dan menjadi topik diskusi yang berkelanjutan.[174]

Jaring makanan dan predasi
[sunting | sunting sumber]Setiap penurunan jumlah amfibi akan memengaruhi pola predasi. Hilangnya spesies karnivora di dekat puncak rantai makanan akan mengganggu keseimbangan ekosistem yang rapuh dan dapat menyebabkan peningkatan dramatis spesies oportunistik.
Predator yang memangsa amfibi terpengaruh oleh penurunan populasi mereka. Ular garter terestrial barat (Thamnophis elegans) di California sebagian besar bersifat akuatik dan sangat bergantung pada dua spesies katak yang jumlahnya menurun, kodok Yosemite (Bufo canorus) dan katak kaki kuning gunung (Rana muscosa), sehingga menempatkan masa depan ular tersebut dalam risiko. Jika ular tersebut menjadi langka, hal ini akan memengaruhi burung pemangsa dan predator lain yang memakannya.[175] Sementara itu, di kolam dan danau, lebih sedikit katak berarti lebih sedikit berudu. Berudu biasanya memainkan peran penting dalam mengendalikan pertumbuhan alga dan juga mencari makan pada detritus yang menumpuk sebagai sedimen di dasar. Pengurangan jumlah berudu dapat menyebabkan pertumbuhan alga yang berlebihan, yang mengakibatkan penipisan oksigen di dalam air ketika alga tersebut kemudian mati dan membusuk. Invertebrata akuatik dan ikan kemudian bisa mati dan akan ada konsekuensi ekologis yang tidak terduga.[176]
Polusi dan pestisida
[sunting | sunting sumber]Penurunan populasi amfibi dan reptil telah menyebabkan kesadaran akan efek pestisida pada reptil dan amfibi.[177] Di masa lalu, argumen bahwa amfibi atau reptil lebih rentan terhadap kontaminasi kimia apa pun daripada vertebrata akuatik darat lainnya tidak didukung oleh penelitian hingga baru-baru ini.[177] Amfibi dan reptil memiliki siklus hidup yang kompleks, hidup di zona iklim dan ekologi yang berbeda, serta lebih rentan terhadap paparan bahan kimia. Pestisida tertentu, seperti organofosfat, neonikotinoid, dan karbamat, bereaksi melalui penghambatan kolinesterase. Kolinesterase adalah enzim yang menyebabkan hidrolisis asetilkolin, neurotransmiter rangsang yang melimpah di sistem saraf. Inhibitor AChE dapat bersifat reversibel atau ireversibel, dan karbamat lebih aman daripada insektisida organofosfor, yang lebih mungkin menyebabkan keracunan kolinergik. Paparan reptil terhadap pestisida penghambat AChE dapat mengakibatkan gangguan fungsi saraf pada reptil. Penumpukan efek penghambatan ini berdampak pada kinerja motorik, seperti konsumsi makanan dan aktivitas lainnya.
Strategi konservasi dan perlindungan
[sunting | sunting sumber]Kelompok Spesialis Amfibi IUCN memelopori upaya penerapan strategi global yang komprehensif bagi konservasi amfibi.[178] Amphibian Ark adalah organisasi yang dibentuk untuk mengimplementasikan rekomendasi konservasi ex-situ dari rencana ini, dan mereka telah bekerja sama dengan kebun binatang serta akuarium di seluruh dunia, mendorong pembentukan koloni jaminan bagi amfibi yang terancam punah.[178] Salah satu proyek tersebut adalah Proyek Penyelamatan dan Konservasi Amfibi Panama yang mengembangkan upaya konservasi yang telah ada di Panama untuk menciptakan tanggapan berskala nasional terhadap ancaman kitridiomikosis.[179]
Langkah lainnya adalah menghentikan eksploitasi katak untuk konsumsi manusia. Di Timur Tengah, meningkatnya selera mengonsumsi paha katak dan perburuan yang diakibatkannya untuk dijadikan makanan telah dikaitkan dengan peningkatan populasi nyamuk, sehingga menimbulkan konsekuensi langsung bagi kesehatan manusia.[180]
Lihat pula
[sunting | sunting sumber]- Terowongan amfibi dan reptil
- Ikan amfibi
- Penggambaran budaya tentang amfibi
- Daftar amfibi
- Daftar genus amfibi
- Daftar reptil dan amfibi terancam punah di Amerika Serikat
- Labi-labi – Sebuah famili taksonomi dari sejumlah genus kura-kura yang memiliki kemampuan untuk "bernapas" di bawah air dengan gerakan ritmis rongga mulut mereka, yang mengandung banyak prosesus yang disuplai secara melimpah oleh darah, bertindak serupa dengan filamen insang pada ikan.
- Ular laut cincin – Spesies ular laut berbisa yang memiliki kemampuan untuk bernapas di bawah air dengan bantuan jaringan vaskular yang luas di bagian atas kepalanya guna menyerap oksigen dari air di sekitarnya.
- Respirasi kutan
- Respirasi enteral
Referensi
[sunting | sunting sumber]- ↑ Marjanović, D. (2021). "The Making of Calibration Sausage Exemplified by Recalibrating the Transcriptomic Timetree of Jawed Vertebrates". Frontiers in Genetics. 12 521693. doi:10.3389/fgene.2021.521693. PMC 8149952. PMID 34054911.
- ↑ Werneburg, R. Witzmann, F. & Schneider, J.W. (2019) The oldest known tetrapod (Temnospondyli) from Germany (Early Carboniferous, Viséan). PalZ (2019) 93:679–690 https://doi.org/10.1007/s12542-018-00442-x
- 1 2 Blackburn, D.C. & Wake, D.B. (2011). "Class Amphibia Gray, 1825". DOI:10.11646/zootaxa.3148.1.8. Archived (PDF) from the original on May 18, 2016. Retrieved November 29, 2012. In: Zhang, Z.-Q. (Ed.) "Animal biodiversity: An outline of higher-level classfication and survey of taxonomic richness". Zootaxa, 3148 (1), 39–55.
- ↑ Lamb, Jennifer Y.; Davis, Matthew P. (27 Februari 2020). "Salamanders and other amphibians are aglow with biofluorescence". Scientific Reports (dalam bahasa Inggris). 10 (1): 2821. Bibcode:2020NatSR..10.2821L. doi:10.1038/S41598-020-59528-9. ISSN 2045-2322. PMC 7046780. PMID 32108141. S2CID 257031840. Wikidata Q89930490.
- 1 2 Atkins, Jade B.; Reisz, Robert R.; Maddin, Hillary C. (March 22, 2019). "Braincase simplification and the origin of lissamphibians". PLOS ONE (dalam bahasa Inggris). 14 (3) e0213694. Bibcode:2019PLoSO..1413694A. doi:10.1371/journal.pone.0213694. ISSN 1932-6203. PMC 6430379. PMID 30901341.
...there has been a growing consensus that lissamphibians are a monophyletic assemblage derived from within Temnospondyli, and more specifically from within the amphibamid dissorophoids.
- ↑ Marjanović, D. & Laurin, M. (2019) Phylogeny of Paleozoic limbed vertebrates reassessed through revision and expansion of the largest published relevant data matrix. PeerJ:6:e5565. doi: 10.7717/peerj.5565. eCollection 2019.
- ↑ "Back to school: temno superlatives". Bryan Gee, PhD (dalam bahasa Inggris). Diakses tanggal 2022-06-29.
- ↑ Skeat, Walter W. (1897). A Concise Etymological Dictionary of the English Language. Clarendon Press. hlm. 39.
- ↑ Baird, Donald (May 1965). "Paleozoic lepospondyl amphibians". Integrative and Comparative Biology. 5 (2): 287–294. doi:10.1093/icb/5.2.287.
- 1 2 3 "Species by number". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal January 12, 2021. Diakses tanggal 2021-01-11.
- ↑ Frost, Darrel (2013). "American Museum of Natural History: Amphibian Species of the World 5.6, an Online Reference". The American Museum of Natural History. Diarsipkan dari versi aslinya tanggal June 14, 2012. Diakses tanggal October 24, 2013.
- ↑ "Amphibiaweb". Diarsipkan dari versi aslinya tanggal November 25, 2019. Diakses tanggal April 1, 2019.
- 1 2 Crump, Martha L. (2009). "Amphibian diversity and life history" (PDF). Amphibian Ecology and Conservation. A Handbook of Techniques: 3–20. doi:10.1093/oso/9780199541188.003.0001. ISBN 978-0-19-954118-8. Diarsipkan dari asli (PDF) tanggal July 15, 2011.
- ↑ Speer, B. W.; Waggoner, Ben (1995). "Amphibia: Systematics". University of California Museum of Paleontology. Diarsipkan dari versi aslinya tanggal March 7, 2013. Diakses tanggal December 13, 2012.
- 1 2 3 Stebbins & Cohen 1995, hlm. 3.
- 1 2 3 Anderson, J.; Reisz, R.; Scott, D.; Fröbisch, N.; Sumida, S. (2008). "A stem batrachian from the Early Permian of Texas and the origin of frogs and salamanders". Nature. 453 (7194): 515–518. Bibcode:2008Natur.453..515A. doi:10.1038/nature06865. PMID 18497824. S2CID 205212809. Diarsipkan dari versi aslinya tanggal July 14, 2021. Diakses tanggal November 10, 2016.
- ↑ Roček, Z. (2000). "14. Mesozoic Amphibians" (PDF). Dalam Heatwole, H.; Carroll, R. L. (ed.). Amphibian Biology: Paleontology: The Evolutionary History of Amphibians. Vol. 4. Surrey Beatty & Sons. hlm. 1295–1331. ISBN 978-0-949324-87-0. Diarsipkan (PDF) dari versi aslinya tanggal July 18, 2011. Diakses tanggal September 29, 2012.
- ↑ Jenkins, Farish A. Jr.; Walsh, Denis M.; Carroll, Robert L. (2007). "Anatomy of Eocaecilia micropodia, a limbed caecilian of the Early Jurassic". Bulletin of the Museum of Comparative Zoology. 158 (6): 285–365. doi:10.3099/0027-4100(2007)158[285:AOEMAL]2.0.CO;2. S2CID 86379456.
- ↑ Gaoa, Ke-Qin; Shubin, Neil H. (2012). "Late Jurassic salamandroid from western Liaoning, China". Proceedings of the National Academy of Sciences of the United States of America. 109 (15): 5767–5772. Bibcode:2012PNAS..109.5767G. doi:10.1073/pnas.1009828109. PMC 3326464. PMID 22411790.
- ↑ Cannatella, David (2008). "Salientia". Tree of Life Web Project. Diarsipkan dari versi aslinya tanggal April 22, 2019. Diakses tanggal August 31, 2012.
- 1 2 3 "Evolution of amphibians". University of Waikato: Plant and animal evolution. Diarsipkan dari versi aslinya tanggal June 27, 2016. Diakses tanggal September 30, 2012.
- 1 2 3 Carroll, Robert L. (1977). Hallam, Anthony (ed.). Patterns of Evolution, as Illustrated by the Fossil Record. Elsevier. hlm. 405–420. ISBN 978-0-444-41142-6. Diarsipkan dari versi aslinya tanggal April 14, 2021. Diakses tanggal October 15, 2020.
- 1 2 Clack, Jennifer A. (2006). "Ichthyostega". Tree of Life Web Project. Diarsipkan dari versi aslinya tanggal June 14, 2020. Diakses tanggal September 29, 2012.
- ↑ Lombard, R. E.; Bolt, J. R. (1979). "Evolution of the tetrapod ear: an analysis and reinterpretation". Biological Journal of the Linnean Society. 11 (1): 19–76. doi:10.1111/j.1095-8312.1979.tb00027.x. Diarsipkan dari versi aslinya tanggal October 4, 2018. Diakses tanggal November 10, 2016.
- 1 2 3 Spoczynska, J. O. I. (1971). Fossils: A Study in Evolution. Frederick Muller Ltd. hlm. 120–125. ISBN 978-0-584-10093-8.
- ↑ Sahney, S.; Benton, M.J. & Ferry, P.A. (2010). "Links between global taxonomic diversity, ecological diversity and the expansion of vertebrates on land". Biology Letters. 6 (4): 544–547. doi:10.1098/rsbl.2009.1024. PMC 2936204. PMID 20106856.
- ↑ Sahney, S. ; Benton, M.J. (2008). "Recovery from the most profound mass extinction of all time". Proceedings of the Royal Society B: Biological Sciences. 275 (1636): 759–65. doi:10.1098/rspb.2007.1370. PMC 2596898. PMID 18198148.
- ↑ San Mauro, D. (2010). "A multilocus timescale for the origin of extant amphibians". Molecular Phylogenetics and Evolution. 56 (2): 554–561. Bibcode:2010MolPE..56..554S. doi:10.1016/j.ympev.2010.04.019. PMID 20399871. Diarsipkan dari versi aslinya tanggal December 12, 2019. Diakses tanggal November 10, 2016.
- ↑ San Mauro, Diego; Vences, Miguel; Alcobendas, Marina; Zardoya, Rafael; Meyer, Axel (2005). "Initial diversification of living amphibians predated the breakup of Pangaea". The American Naturalist. 165 (5): 590–599. Bibcode:2005ANat..165..590S. doi:10.1086/429523. PMID 15795855. S2CID 17021360. Diarsipkan dari versi aslinya tanggal February 7, 2017. Diakses tanggal November 10, 2016.
- ↑ "Tiny fossils reveal backstory of the most mysterious amphibian alive". ScienceDaily. Diarsipkan dari versi aslinya tanggal November 5, 2019. Diakses tanggal June 28, 2017.
- 1 2 3 4 Dorit, Walker & Barnes 1991, hlm. 843–859.
- ↑ Laurin, Michel (2011). "Terrestrial Vertebrates". Tree of Life Web Project. Diarsipkan dari versi aslinya tanggal March 1, 2011. Diakses tanggal September 16, 2012.
- ↑ Laurin, Michel; Gauthier, Jacques A. (2012). "Amniota". Tree of Life Web Project. Diarsipkan dari versi aslinya tanggal June 1, 2020. Diakses tanggal September 16, 2012.
- ↑ Sumich, James L.; Morrissey, John F. (2004). Introduction to the Biology of Marine Life. Jones & Bartlett Learning. hlm. 171. ISBN 978-0-7637-3313-1. Diarsipkan dari versi aslinya tanggal April 14, 2021. Diakses tanggal October 15, 2020.
- ↑ IUCN SSC Amphibian Specialist Group. (2015). "Ambystoma andersoni" e.T59051A176772780. doi:10.2305/IUCN.UK.2015-4.RLTS.T59051A176772780.en. ;
- ↑ Wells, Kentwood D. (February 15, 2010). The Ecology and Behavior of Amphibians. University of Chicago Press. ISBN 978-0-226-89333-4. Diarsipkan dari versi aslinya tanggal June 25, 2020. Diakses tanggal June 19, 2020 – via Google Books.
- ↑ Levy, Daniel L.; Heald, Rebecca (January 20, 2016). "Biological Scaling Problems and Solutions in Amphibians". Cold Spring Harbor Perspectives in Biology. 8 (1) a019166. doi:10.1101/cshperspect.a019166. PMC 4691792. PMID 26261280.
- ↑ Schoch, Rainer R. (March 19, 2014). Amphibian Evolution: The Life of Early Land Vertebrates. John Wiley & Sons. ISBN 978-1-118-75913-4. Diarsipkan dari versi aslinya tanggal July 25, 2020. Diakses tanggal July 21, 2020 – via Google Books.
- ↑ Michel Laurin (2004). "The evolution of body size, Cope's rule and the origin of amniotes". Systematic Biology. 53 (4): 594–622. doi:10.1080/10635150490445706. PMID 15371249. Diarsipkan dari versi aslinya tanggal July 14, 2021. Diakses tanggal July 21, 2020.
- ↑ Rittmeyer, Eric N.; Allison, Allen; Gründler, Michael C.; Thompson, Derrick K.; Austin, Christopher C. (2012). "Ecological guild evolution and the discovery of the world's smallest vertebrate". PLOS ONE. 7 (1) e29797. Bibcode:2012PLoSO...729797R. doi:10.1371/journal.pone.0029797. PMC 3256195. PMID 22253785.
- 1 2 Nguyen, Brent; Cavagnaro, John (July 2012). "Amphibian Facts". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal January 23, 2014. Diakses tanggal November 9, 2012.
- ↑ Price, L. I. (1948). "Um anfibio Labirinthodonte da formacao Pedra de Fogo, Estado do Maranhao". Boletim. 24. Ministerio da Agricultura, Departamento Nacional da Producao ineral Divisao de Geologia e Mineralogia: 7–32.
- ↑ Stebbins & Cohen 1995, hlm. 24–25.
- ↑ Cannatella, David; Graybeal, Anna (2008). "Bufonidae, True Toads". Tree of Life Web Project. Diarsipkan dari versi aslinya tanggal June 14, 2020. Diakses tanggal December 1, 2012.
- ↑ "Frog fun facts". American Museum of Natural History. January 12, 2010. Diarsipkan dari versi aslinya tanggal February 24, 2013. Diakses tanggal August 29, 2012.
- ↑ Challenger, David (January 12, 2012). "World's smallest frog discovered in Papua New Guinea". CNN. Diarsipkan dari versi aslinya tanggal April 20, 2012. Diakses tanggal August 29, 2012.
- 1 2 3 4 5 6 7 Arnold, Nicholas; Ovenden, Denys (2002). Reptiles and Amphibians of Britain and Europe. Harper Collins Publishers. hlm. 13–18. ISBN 978-0-00-219318-4.
- ↑ Faivovich, J.; Haddad, C. F. B.; Garcia, P. C. A.; Frost, D. R.; Campbell, J. A.; Wheeler, W. C. (2005). "Systematic review of the frog family Hylidae, with special reference to Hylinae: Phylogenetic analysis and revision". Bulletin of the American Museum of Natural History. 294: 1–240. CiteSeerX 10.1.1.470.2967. doi:10.1206/0003-0090(2005)294[0001:SROTFF]2.0.CO;2. S2CID 83925199.
- 1 2 Ford, L. S.; Cannatella, D. C. (1993). "The major clades of frogs". Herpetological Monographs. 7: 94–117. doi:10.2307/1466954. JSTOR 1466954.
- ↑ San Mauro, Diego; Vences, Miguel; Alcobendas, Marina; Zardoya, Rafael; Meyer, Axel (2005). "Initial diversification of living amphibians predated the breakup of Pangaea". American Naturalist. 165 (5): 590–599. Bibcode:2005ANat..165..590S. doi:10.1086/429523. PMID 15795855. S2CID 17021360. Diarsipkan dari versi aslinya tanggal February 7, 2017. Diakses tanggal November 10, 2016.
- ↑ Baum, David (2008). "Trait Evolution on a Phylogenetic Tree: Relatedness, Similarity, and the Myth of Evolutionary Advancement". Nature Education. Diarsipkan dari versi aslinya tanggal March 8, 2014. Diakses tanggal December 1, 2012.
- ↑ Sparreboom, Max (February 7, 2000). "Andrias davidianus Chinese giant salamander". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal December 26, 2012. Diakses tanggal December 1, 2012.
- ↑ Wake, David B. (November 8, 2000). "Thorius pennatulus". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal May 15, 2012. Diakses tanggal August 25, 2012.
- ↑ Elmer, K. R.; Bonett, R. M.; Wake, D. B.; Lougheed, S. C. (2013-03-04). "Early Miocene origin and cryptic diversification of South American salamanders". BMC Evolutionary Biology. 13 (1): 59. Bibcode:2013BMCEE..13...59E. doi:10.1186/1471-2148-13-59. PMC 3602097. PMID 23497060.
- ↑ Larson, A.; Dimmick, W. (1993). "Phylogenetic relationships of the salamander families: an analysis of the congruence among morphological and molecular characters". Herpetological Monographs. 7 (7): 77–93. doi:10.2307/1466953. JSTOR 1466953.
- ↑ Dorit, Walker & Barnes 1991, hlm. 852.
- ↑ Heying, Heather (2003). "Cryptobranchidae". Animal Diversity Web. University of Michigan. Diarsipkan dari versi aslinya tanggal October 21, 2012. Diakses tanggal August 25, 2012.
- 1 2 Mayasich, J.; Grandmaison, D.; Phillips, C. (June 1, 2003). "Eastern Hellbender Status Assessment Report" (PDF). U.S. Fish and Wildlife Service. Diarsipkan (PDF) dari versi aslinya tanggal September 4, 2012. Diakses tanggal August 25, 2012.
- 1 2 3 Wake, David B. "Caudata". Encyclopædia Britannica. Diarsipkan dari versi aslinya tanggal May 16, 2013. Diakses tanggal August 25, 2012.
- ↑ Cogger, H. G. (1998). Zweifel, R. G (ed.). Encyclopedia of Reptiles and Amphibians. Academic Press. hlm. 69–70. ISBN 978-0-12-178560-4.
- ↑ Stebbins & Cohen 1995, hlm. 4.
- ↑ Dorit, Walker & Barnes 1991, hlm. 858.
- ↑ Duellman, William E. "Gymnophiona". Encyclopædia Britannica. Diarsipkan dari versi aslinya tanggal January 14, 2012. Diakses tanggal September 30, 2012.
- ↑ Zylberberg, Louise; Wake, Marvalee H. (1990). "Structure of the scales of Dermophis and Microcaecilia (Amphibia: Gymnophiona), and a comparison to dermal ossifications of other vertebrates". Journal of Morphology. 206 (1): 25–43. Bibcode:1990JMorp.206...25Z. doi:10.1002/jmor.1052060104. PMID 29865751. S2CID 46929507. Diarsipkan dari versi aslinya tanggal December 16, 2017. Diakses tanggal November 10, 2016.
- ↑ Biodiversity Institute of Ontario; Hebert, Paul D. N. (October 12, 2008). "Amphibian morphology and reproduction". Encyclopedia of Earth. Diarsipkan dari versi aslinya tanggal February 1, 2008. Diakses tanggal August 15, 2012.
- ↑ Stebbins & Cohen 1995, hlm. 10–11.
- ↑ Spearman, R. I. C. (1973). The Integument: A Textbook of Skin Biology. Cambridge University Press. hlm. 81. ISBN 978-0-521-20048-6.
Amphibian skin colour.
- 1 2 3 4 Dorit, Walker & Barnes 1991, hlm. 846.
- 1 2 3 Stebbins & Cohen 1995, hlm. 26–36.
- 1 2 Beneski, John T. Jr. (September 1989). "Adaptive significance of tail autotomy in the salamander, Ensatina". Journal of Herpetology. 23 (3): 322–324. doi:10.2307/1564465. JSTOR 1564465.
- ↑ Dorit, Walker & Barnes 1991, hlm. 306.
- ↑ González, A.; López, J. M.; Morona, R.; Morona, N. (2020). "The Organization of the Central Nervous System of Amphibians". Dalam Hass, J. H. (ed.). Evolutionary Neuroscience. Elsevier Science. hlm. 127. ISBN 978-0-12-820584-6.
- ↑ Stebbins & Cohen 1995, hlm. 100.
- ↑ A Natural History of Amphibians
- ↑ Stebbins & Cohen 1995, hlm. 69.
- 1 2 3 Duellman, William E.; Zug, George R. (2012). "Amphibian". Encyclopædia Britannica. Diarsipkan dari versi aslinya tanggal March 8, 2012. Diakses tanggal March 27, 2012.
- 1 2 3 Dorit, Walker & Barnes 1991, hlm. 847.
- ↑ Stebbins & Cohen 1995, hlm. 66.
- 1 2 Dorit, Walker & Barnes 1991, hlm. 849.
- ↑ Urakabe, Shigeharu; Shirai, Dairoku; Yuasa, Shigekazu; Kimura, Genjiro; Orita, Yoshimasa; Abe, Hiroshi (1976). "Comparative study of the effects of different diuretics on the permeability properties of the toad bladder". Comparative Biochemistry and Physiology Part C: Comparative Pharmacology (dalam bahasa Inggris). 53 (2): 115–119. doi:10.1016/0306-4492(76)90063-0. PMID 5237.
- ↑ Shibata, Yuki; Katayama, Izumi; Nakakura, Takashi; Ogushi, Yuji; Okada, Reiko; Tanaka, Shigeyasu; Suzuki, Masakazu (2015). "Molecular and cellular characterization of urinary bladder-type aquaporin in Xenopus laevis". General and Comparative Endocrinology. 222: 11–19. doi:10.1016/j.ygcen.2014.09.001. PMID 25220852.
- 1 2 Laurie J. Vitt; Janalee P. Caldwell (25 March 2013). Herpetology: An Introductory Biology of Amphibians and Reptiles. Academic. hlm. 184. ISBN 978-0-12-386920-3.
- ↑ Feder, Martin E.; Burggren, Warren W. (1992-10-15). Environmental Physiology of the Amphibians (dalam bahasa Inggris). University of Chicago Press. ISBN 978-0-226-23944-6.
- ↑ Brainerd, E. L. (1999). "New perspectives on the evolution of lung ventilation mechanisms in vertebrates". Experimental Biology Online. 4 (2): 1–28. Bibcode:1999EvBO....4b...1B. doi:10.1007/s00898-999-0002-1. S2CID 35368264.
- ↑ Hopkins Gareth R.; Brodie Edmund D. Jr (2015). "Occurrence of Amphibians in Saline Habitats: A Review and Evolutionary Perspective". Herpetological Monographs. 29 (1): 1–27. doi:10.1655/HERPMONOGRAPHS-D-14-00006. S2CID 83659304.
- ↑ Natchev, Nikolay; Tzankov, Nikolay; Geme, Richard (2011). "Green frog invasion in the Black Sea: habitat ecology of the Pelophylax esculentus complex (Anura, Amphibia) population in the region of Shablenska Tuzla lagoon in Bulgaria" (PDF). Herpetology Notes. 4: 347–351. Diarsipkan dari asli (PDF) tanggal September 24, 2015. Diakses tanggal August 17, 2012.
- ↑ Hogan, C. Michael (July 31, 2010). "Abiotic factor". Encyclopedia of Earth. National Council for Science and the Environment. Diarsipkan dari asli tanggal June 8, 2013. Diakses tanggal September 30, 2012.
- ↑ Stebbins & Cohen 1995, hlm. 140–141.
- 1 2 Duellman, William E.; Trueb, Linda (1994). Biology of Amphibians. JHU Press. hlm. 77–79. ISBN 978-0-8018-4780-6. Diarsipkan dari versi aslinya tanggal February 3, 2021. Diakses tanggal October 15, 2020.
- 1 2 Stebbins & Cohen 1995, hlm. 154–162.
- ↑ Adams, Michael J.; Pearl, Christopher A. (2005). "Ascaphus truei". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal November 4, 2012. Diakses tanggal November 23, 2012.
- ↑ Romano, Antonio; Bruni, Giacomo (2011). "Courtship behaviour, mating season and male sexual interference in Salamandrina perspicillata". Amphibia-Reptilia. 32 (1): 63–76. doi:10.1163/017353710X541878.
- ↑ Adams, Erika M.; Jones, A. G.; Arnold, S. J. (2005). "Multiple paternity in a natural population of a salamander with long-term sperm storage". Molecular Ecology. 14 (6): 1803–1810. Bibcode:2005MolEc..14.1803A. doi:10.1111/j.1365-294X.2005.02539.x. PMID 15836651. S2CID 18899524. Diarsipkan dari versi aslinya tanggal October 4, 2018. Diakses tanggal November 10, 2016.
- ↑ Bogart JP, Bi K, Fu J, Noble DW, Niedzwiecki J. Unisexual salamanders (genus Ambystoma) present a new reproductive mode for eukaryotes. Genome. 2007 Feb;50(2):119-36. doi: 10.1139/g06-152. PMID 17546077
- 1 2 Gibbs HL, Denton RD. Cryptic sex? Estimates of genome exchange in unisexual mole salamanders (Ambystoma sp.). Mol Ecol. 2016 Jun;25(12):2805-15. doi: 10.1111/mec.13662. Epub 2016 May 21. PMID 27100619
- ↑ Kikuyama, Sakae; Kawamura, Kousuke; Tanaka, Shigeyasu; Yamamoto, Kakutoshi (1993). "Aspects of amphibian metamorphosis: Hormonal control". International Review of Cytology: A Survey of Cell Biology. Academic Press. hlm. 105–126. ISBN 978-0-12-364548-7. Diarsipkan dari versi aslinya tanggal April 14, 2021. Diakses tanggal October 15, 2020.
- ↑ Newman, Robert A. (1992). "Adaptive plasticity in amphibian metamorphosis". BioScience. 42 (9): 671–678. doi:10.2307/1312173. JSTOR 1312173.
- ↑ Gilbert, Perry W. (1942). "Observations on the eggs of Ambystoma maculatum with especial reference to the green algae found within the egg envelopes". Ecology. 23 (2): 215–227. Bibcode:1942Ecol...23..215G. doi:10.2307/1931088. JSTOR 1931088.
- ↑ Waldman, Bruce; Ryan, Michael J. (1983). "Thermal advantages of communal egg mass deposition in wood frogs (Rana sylvatica)". Journal of Herpetology. 17 (1): 70–72. Bibcode:1983JHerp..17...70W. doi:10.2307/1563783. JSTOR 1563783. Diarsipkan dari versi aslinya tanggal July 14, 2021. Diakses tanggal November 10, 2016.
- ↑ Alder, Kraig; Trueb, Linda (2002). "Amphibians". Dalam Halliday, Tim; Adler, Kraig (ed.). The Firefly Encyclopedia of Reptiles and Amphibians. Firefly Books. hlm. 17. ISBN 978-1-55297-613-5.
- ↑ Meshaka, Walter E. Jr. "Eleutherodactylus planirostris". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal June 9, 2013. Diakses tanggal December 12, 2012.
- ↑ Dalgetty, Laura; Kennedy, Malcolm W. (2010). "Building a home from foam: túngara frog foam nest architecture and three-phase construction process". Biology Letters. 6 (3): 293–296. doi:10.1098/rsbl.2009.0934. PMC 2880057. PMID 20106853.
- ↑ "Proteins of frog foam nests". School of Life Sciences, University of Glasgow. Diarsipkan dari versi aslinya tanggal June 3, 2013. Diakses tanggal August 24, 2012.
- ↑ Stebbins & Cohen 1995, hlm. 6–9.
- ↑ Vitt, Laurie J.; Caldwell, Janalee P. (2013). Herpetology: An Introductory Biology of Amphibians and Reptiles. Academic Press. hlm. 42. ISBN 978-0-12-386919-7.
- ↑ Janzen, Peter (May 10, 2005). "Nannophrys ceylonensis". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal June 7, 2022. Diakses tanggal July 20, 2012.
- ↑ Duellman, W. E.; Zug, G. R. "Anura: From tadpole to adult". Encyclopædia Britannica. Diarsipkan dari versi aslinya tanggal November 2, 2012. Diakses tanggal July 13, 2012.
- ↑ Comparative Anatomy and Developmental Biology of Vertebrates (Zoology Book)
- ↑ Biological Systems in Vertebrates, Vol. 1 Functional Morphology of the Vertebrate Respiratory Systems
- ↑ Biology of Amphibians
- ↑ Stebbins & Cohen 1995, hlm. 179–181.
- ↑ Venturi, Sebastiano (2011). "Evolutionary Significance of Iodine". Current Chemical Biology. 5 (3): 155–162. doi:10.2174/187231311796765012 (tidak aktif July 1, 2025). ISSN 1872-3136. Diarsipkan dari versi aslinya tanggal December 9, 2019. Diakses tanggal November 10, 2016. Pemeliharaan CS1: DOI nonaktif per Juli 2025 (link)
- ↑ Venturi, Sebastiano (2014). "Iodine, PUFAs and Iodolipids in Health and Disease: An Evolutionary Perspective". Human Evolution. 29 (1–3): 185–205. ISSN 0393-9375.
- 1 2 3 Duellman, William E.; Zug, George R. (2012). "Anura". Encyclopædia Britannica. Diarsipkan dari versi aslinya tanggal November 2, 2012. Diakses tanggal March 26, 2012.
- ↑ Crump, Martha L. (1986). "Cannibalism by younger tadpoles: another hazard of metamorphosis". Copeia. 1986 (4): 1007–1009. Bibcode:1986Copei1986.1007C. doi:10.2307/1445301. JSTOR 1445301.
- 1 2 Wake, David B. (2012). "Caudata". Encyclopædia Britannica. Diarsipkan dari versi aslinya tanggal May 16, 2013. Diakses tanggal March 26, 2012.
- ↑ Valentine, Barry D.; Dennis, David M. (1964). "A comparison of the gill-arch system and fins of three genera of larval salamanders, Rhyacotriton, Gyrinophilus, and Ambystoma". Copeia. 1964 (1): 196–201. Bibcode:1964Copei1964..196V. doi:10.2307/1440850. JSTOR 1440850.
- ↑ Shaffer, H. Bradley (2005). "Ambystoma gracile". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal December 26, 2012. Diakses tanggal November 21, 2012.
- 1 2 Duellman, William E.; Trueb, Linda (1994). Biology of Amphibians. JHU Press. hlm. 191–192. ISBN 978-0-8018-4780-6. Diarsipkan dari versi aslinya tanggal January 26, 2021. Diakses tanggal October 15, 2020.
- ↑ Kiyonaga, Robin R. "Metamorphosis vs. neoteny (paedomorphosis) in salamanders (Caudata)". Diarsipkan dari versi aslinya tanggal August 20, 2012. Diakses tanggal November 21, 2012.
- ↑ Stebbins & Cohen 1995, hlm. 196.
- ↑ Shaffer, H. Bradley; Austin, C. C.; Huey, R. B. (1991). "The consequences of metamorphosis on salamander (Ambystoma) locomotor performance" (PDF). Physiological Zoology. 64 (1): 212–231. Bibcode:1991PhysZ..64..212S. doi:10.1086/physzool.64.1.30158520. JSTOR 30158520. S2CID 87191067. Diarsipkan dari asli (PDF) tanggal 2020-02-10.
- ↑ Breckenridge, W. R.; Nathanael, S.; Pereira, L. (1987). "Some aspects of the biology and development of Ichthyophis glutinosus". Journal of Zoology. 211 (3): 437–449. doi:10.1111/jzo.1987.211.3.437.
- ↑ Wake, Marvalee H. (1977). "Fetal maintenance and its evolutionary significance in the Amphibia: Gymnophiona". Journal of Herpetology. 11 (4): 379–386. doi:10.2307/1562719. JSTOR 1562719. Diarsipkan dari versi aslinya tanggal October 4, 2018. Diakses tanggal November 10, 2016.
- ↑ Duellman, William E. (2012). "Gymnophiona". Encyclopædia Britannica. Diarsipkan dari versi aslinya tanggal January 14, 2012. Diakses tanggal March 26, 2012.
- ↑ Metamorphosis: A Problem in Developmental Biology
- ↑ Wilkinson, Mark; Kupfer, Alexander; Marques-Porto, Rafael; Jeffkins, Hilary; Antoniazzi, Marta M.; Jared, Carlos (2008). "One hundred million years of skin feeding? Extended parental care in a Neotropical caecilian (Amphibia: Gymnophiona)". Biology Letters. 4 (4): 358–361. doi:10.1098/rsbl.2008.0217. PMC 2610157. PMID 18547909.
- ↑ Crump, Martha L. (1996). "Parental care among the Amphibia". Parental Care: Evolution, Mechanisms, and Adaptive Significance. Advances in the Study of Behavior. Vol. 25. hlm. 109–144. doi:10.1016/S0065-3454(08)60331-9. ISBN 978-0-12-004525-9.
- ↑ Brown, J. L.; Morales, V.; Summers, K. (2010). "A key ecological trait drove the evolution of biparental care and monogamy in an amphibian". American Naturalist. 175 (4): 436–446. Bibcode:2010ANat..175..436B. doi:10.1086/650727. PMID 20180700. S2CID 20270737. Diarsipkan dari versi aslinya tanggal July 29, 2020. Diakses tanggal November 10, 2016.
- ↑ Dorit, Walker & Barnes 1991, hlm. 853–854.
- ↑ Fandiño, María Claudia; Lüddecke, Horst; Amézquita, Adolfo (1997). "Vocalisation and larval transportation of male Colostethus subpunctatus (Anura: Dendrobatidae)". Amphibia-Reptilia. 18 (1): 39–48. doi:10.1163/156853897X00297.
- ↑ van der Meijden, Arie (January 18, 2010). "Alytes obstetricans". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal December 25, 2012. Diakses tanggal November 29, 2012.
- ↑ Semeyn, E. (2002). "Rheobatrachus silus". Animal Diversity Web. University of Michigan Museum of Zoology. Diarsipkan dari versi aslinya tanggal July 6, 2012. Diakses tanggal August 5, 2012.
- ↑ IUCN SSC Amphibian Specialist Group. (2023). "Assa darlingtoni" e.T211150139A78440087. doi:10.2305/IUCN.UK.2023-1.RLTS.T211150139A78440087.en.
- ↑ IUCN SSC Amphibian Specialist Group. (2023). "Pipa pipa" e.T58163A85900348. doi:10.2305/IUCN.UK.2023-1.RLTS.T58163A85900348.en.
- ↑ van Wijngaarden, René; Bolaños, Federico (1992). "Parental care in Dendrobates granuliferus (Anura: Dendrobatidae), with a description of the tadpole". Journal of Herpetology. 26 (1): 102–105. doi:10.2307/1565037. JSTOR 1565037. Diarsipkan dari versi aslinya tanggal October 4, 2018. Diakses tanggal November 10, 2016.
- 1 2 Uno, Yoshinobu (2021). "Inference of evolution of vertebrate genomes and chromosomes from genomic and cytogenetic analyses using amphibians". Chromosome Science. 24 (1–2): 3–12. doi:10.11352/scr.24.3. Diarsipkan dari versi aslinya tanggal September 6, 2021. Diakses tanggal September 6, 2021.
- ↑ Nowoshilow, Sergej; Schloissnig, Siegfried; Fei, Ji-Feng; Dahl, Andreas; Pang, Andy W. C.; Pippel, Martin; Winkler, Sylke; Hastie, Alex R.; Young, George; Roscito, Juliana G.; Falcon, Francisco (2018). "The axolotl genome and the evolution of key tissue formation regulators". Nature. 554 (7690): 50–55. Bibcode:2018Natur.554...50N. doi:10.1038/nature25458. hdl:21.11116/0000-0003-F659-4. ISSN 0028-0836. PMID 29364872. S2CID 256770603.
- ↑ Gabbard, Jesse (2000). "Siren intermedia: Lesser Siren". Animal Diversity Web. University of Michigan Museum of Zoology. Diarsipkan dari versi aslinya tanggal January 2, 2010. Diakses tanggal August 11, 2012.
- ↑ Da Silva, H. R.; De Britto-Pereira, M. C. (2006). "How much fruit do fruit-eating frogs eat? An investigation on the diet of Xenohyla truncata (Lissamphibia: Anura: Hylidae)". Journal of Zoology. 270 (4): 692–698. Bibcode:2006JZoo..270..692D. doi:10.1111/j.1469-7998.2006.00192.x. Diarsipkan dari versi aslinya tanggal June 23, 2019. Diakses tanggal November 10, 2016.
- ↑ Trueb, Linda; Gans, Carl (1983). "Feeding specializations of the Mexican burrowing toad, Rhinophrynus dorsalis (Anura: Rhinophrynidae)" (PDF). Journal of Zoology. 199 (2): 189–208. doi:10.1111/j.1469-7998.1983.tb02090.x. hdl:2027.42/74489. Diarsipkan (PDF) dari versi aslinya tanggal July 27, 2020. Diakses tanggal August 27, 2019.
- ↑ Hamilton, W. J. Jr. (1948). "The food and feeding behavior of the green frog, Rana clamitans Latreille, in New York State". Copeia. 1948 (3). American Society of Ichthyologists and Herpetologists: 203–207. doi:10.2307/1438455. JSTOR 1438455.
- ↑ Stebbins & Cohen 1995, hlm. 56.
- ↑ Stebbins & Cohen 1995, hlm. 57–58.
- ↑ Radcliffe, Charles W.; Chiszar, David; Estep, Karen; Murphy, James B.; Smith, Hobart M. (1986). "Observations on pedal luring and pedal movements in Leptodactylid frogs". Journal of Herpetology. 20 (3): 300–306. doi:10.2307/1564496. JSTOR 1564496.
- ↑ Toft, Catherine A. (1981). "Feeding ecology of Panamanian litter anurans: patterns in diet and foraging mode". Journal of Herpetology. 15 (2): 139–144. doi:10.2307/1563372. JSTOR 1563372. Diarsipkan dari versi aslinya tanggal July 30, 2020. Diakses tanggal November 10, 2016.
- ↑ Bemis, W. E.; Schwenk, K.; Wake, M. H. (1983). "Morphology and function of the feeding apparatus in Dermophis mexicanus (Amphibia: Gymnophiona)". Zoological Journal of the Linnean Society. 77 (1): 75–96. doi:10.1111/j.1096-3642.1983.tb01722.x. Diarsipkan dari versi aslinya tanggal July 30, 2020. Diakses tanggal November 10, 2016.
- ↑ Stebbins & Cohen 1995, hlm. 181–185.
- 1 2 Stebbins & Cohen 1995, hlm. 76–77.
- ↑ Sullivan, Brian K. (1992). "Sexual selection and calling behavior in the American toad (Bufo americanus)". Copeia. 1992 (1): 1–7. Bibcode:1992Copei1992....1S. doi:10.2307/1446530. JSTOR 1446530.
- ↑ Toledo, L. F.; Haddad, C. F. B. (2007). "Capitulo 4" (PDF). When frogs scream! A review of anuran defensive vocalizations (Thesis). Instituto de Biociências, São Paulo. Diarsipkan (PDF) dari versi aslinya tanggal September 4, 2012. Diakses tanggal August 13, 2012.
- ↑ Johnson, Steve A. (2010). "The Cuban Treefrog (Osteopilus septentrionalis) in Florida". EDIS. University of Florida. Diarsipkan dari versi aslinya tanggal August 20, 2012. Diakses tanggal August 13, 2012.
- ↑ Shine, Richard (1979). "Sexual selection and sexual dimorphism in the Amphibia". Copeia. 1979 (2): 297–306. doi:10.2307/1443418. JSTOR 1443418.
- 1 2 3 Gergits, W. F.; Jaeger, R. G. (1990). "Site attachment by the red-backed salamander, Plethodon cinereus". Journal of Herpetology. 24 (1): 91–93. Bibcode:1990JHerp..24...91G. doi:10.2307/1564297. JSTOR 1564297.
- ↑ Casper, Gary S. "Plethodon cinereus". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal June 9, 2013. Diakses tanggal September 25, 2012.
- ↑ Wells, K. D. (1977). "Territoriality and male mating success in the green frog (Rana clamitans)". Ecology. 58 (4): 750–762. Bibcode:1977Ecol...58..750W. doi:10.2307/1936211. JSTOR 1936211.
- 1 2 Barthalmus, G. T.; Zielinski W. J. (1988). "Xenopus skin mucus induces oral dyskinesias that promote escape from snakes". Pharmacology Biochemistry and Behavior. 30 (4): 957–959. doi:10.1016/0091-3057(88)90126-8. PMID 3227042. S2CID 25434883.
- ↑ Crayon, John J. "Xenopus laevis". AmphibiaWeb. Diarsipkan dari versi aslinya tanggal October 9, 2014. Diakses tanggal October 8, 2012.
- ↑ Moodie, G. E. E. (1978). "Observations on the life history of the caecilian Typhlonectes compressicaudus (Dumeril and Bibron) in the Amazon basin". Canadian Journal of Zoology. 56 (4): 1005–1008. Bibcode:1978CaJZ...56.1005M. doi:10.1139/z78-141. Diarsipkan dari versi aslinya tanggal July 5, 2020. Diakses tanggal November 10, 2016.
- ↑ Brodie, Edmund D. Jr. (1968). "Investigations on the skin toxin of the adult rough-skinned newt, Taricha granulosa". Copeia. 1968 (2): 307–313. doi:10.2307/1441757. JSTOR 1441757.
- 1 2 Hanifin, Charles T.; Yotsu-Yamashita, Mari; Yasumoto, Takeshi; Brodie, Edmund D.; Brodie, Edmund D. Jr. (1999). "Toxicity of dangerous prey: variation of tetrodotoxin levels within and among populations of the newt Taricha granulosa". Journal of Chemical Ecology. 25 (9): 2161–2175. Bibcode:1999JCEco..25.2161H. doi:10.1023/A:1021049125805. S2CID 543221. Diarsipkan dari versi aslinya tanggal July 5, 2020. Diakses tanggal November 10, 2016.
- ↑ Geffeney, Shana L.; Fujimoto, Esther; Brodie, Edmund D.; Brodie, Edmund D. Jr.; Ruben, Peter C. (2005). "Evolutionary diversification of TTX-resistant sodium channels in a predator–prey interaction". Nature. 434 (7034): 759–763. Bibcode:2005Natur.434..759G. doi:10.1038/nature03444. PMID 15815629. S2CID 4426708.
- ↑ Stebbins & Cohen 1995, hlm. 110.
- ↑ Patocka, Jiri; Wulff, Kräuff; Palomeque, MaríaVictoria (1999). "Dart Poison Frogs and Their Toxins". ASA Newsletter. 5 (75). ISSN 1057-9419. Diarsipkan dari versi aslinya tanggal March 23, 2014. Diakses tanggal January 29, 2013.
- ↑ Darst, Catherine R.; Cummings, Molly E. (March 9, 2006). "Predator learning favours mimicry of a less-toxic model in poison frogs". Nature. 440 (7081): 208–211. Bibcode:2006Natur.440..208D. doi:10.1038/nature04297. PMID 16525472.
- ↑ Brodie, Edmund D. Jr.; Nowak, Robert T.; Harvey, William R. (1979). "Antipredator secretions and behavior of selected salamanders against shrews". Copeia. 1979 (2): 270–274. doi:10.2307/1443413. JSTOR 1443413.
- ↑ Brodie, E. D. Jr. (1978). "Biting and vocalisation as antipredator mechanisms in terrestrial salamanders". Copeia. 1978 (1): 127–129. doi:10.2307/1443832. JSTOR 1443832.
- ↑ Hloch, A. (2010). What Does a Salamander Remember After Winter? (PDF). University of Vienna. Fakultät für Lebenswissenschaften. Diarsipkan (PDF) dari versi aslinya tanggal October 4, 2018. Diakses tanggal November 15, 2015.
- ↑ Lambert, Helen; Elwin, Angie; D'Cruze, Neil (1 February 2022). "Frog in the well: A review of the scientific literature for evidence of amphibian sentience". Applied Animal Behaviour Science (dalam bahasa Inggris). 247 105559. doi:10.1016/j.applanim.2022.105559. ISSN 0168-1591. Diakses tanggal 26 May 2023.
- ↑ Stancher, G.; Rugani, R.; Regolin, L.; Vallortigara, G. (2015). "Numerical discrimination by frogs (Bombina orientalis)". Animal Cognition. 18 (1): 219–229. doi:10.1007/s10071-014-0791-7. PMID 25108417. S2CID 16499583. Diarsipkan dari versi aslinya tanggal July 14, 2021. Diakses tanggal November 10, 2016.
- ↑ McCallum, M. L. (2007). "Amphibian decline or extinction? Current declines dwarf background extinction rate". Journal of Herpetology. 41 (3): 483–491. doi:10.1670/0022-1511(2007)41[483:ADOECD]2.0.CO;2. S2CID 30162903.
- ↑ "What does it mean to be human?". The Smithsonian Institution's Human Origins Program. Smithsonian National Museum of Natural History. Diarsipkan dari versi aslinya tanggal November 22, 2013. Diakses tanggal November 19, 2013.
- ↑ Hoekstra, J. M.; Molnar, J. L.; Jennings, M.; Revenga, C.; Spalding, M. D.; Boucher, T. M.; Robertson, J. C.; Heibel, T. J.; Ellison, K. (2010). "Number of Globally Threatened Amphibian Species by Freshwater Ecoregion". The Atlas of Global Conservation: Changes, Challenges, and Opportunities to Make a Difference. The Nature Conservancy. Diarsipkan dari versi aslinya tanggal October 27, 2012. Diakses tanggal September 5, 2012.
- ↑ "Amphibian Specialist Group". IUCN SSC Amphibian Specialist Group. Diarsipkan dari versi aslinya tanggal February 22, 2011. Diakses tanggal March 30, 2012.
- ↑ Jennings, W. Bryan; Bradford, David F.; Johnson, Dale F. (1992). "Dependence of the garter snake Thamnophis elegans on amphibians in the Sierra Nevada of California". Journal of Herpetology. 26 (4): 503–505. Bibcode:1992JHerp..26..503J. doi:10.2307/1565132. JSTOR 1565132. Diarsipkan dari versi aslinya tanggal October 4, 2018. Diakses tanggal November 10, 2016.
- ↑ Stebbins & Cohen 1995, hlm. 249.
- 1 2 Hall, J.R.; Henry, F.P.P. (1992). "Review: Assessing Effects of Pesticide on Amphibians and Reptiles: Status and needs". Herpetological Journal. 2: 65–71.
- 1 2 "Amphibian Conservation Action Plan". IUCN. Diarsipkan dari asli tanggal April 27, 2012. Diakses tanggal March 30, 2012.
- ↑ "Panama Amphibian Rescue and Conservation Project". Amphibian Ark. Diarsipkan dari asli tanggal June 14, 2010. Diakses tanggal March 30, 2012.
- ↑ Regier, Henry A.; Baskerville, Gordon L. (1996). "Sustainable redevelopment of regional ecosystems degraded by exploitive development". Sustainability Issues for Resource Managers. DIANE Publishing. hlm. 36–38. ISBN 978-0-7881-4699-2. Diarsipkan dari versi aslinya tanggal April 14, 2021. Diakses tanggal October 15, 2020.
Teks yang dikutip
[sunting | sunting sumber]- Dorit, R. L.; Walker, W. F.; Barnes, R. D. (1991). Zoology. Saunders College Publishing. ISBN 978-0-03-030504-7.
- Stebbins, Robert C.; Cohen, Nathan W. (1995). A Natural History of Amphibians. Princeton University Press. ISBN 978-0-691-03281-8.
Bacaan lanjutan
[sunting | sunting sumber]- Carroll, Robert L. (1988). Vertebrate Paleontology and Evolution. W. H. Freeman. ISBN 978-0-7167-1822-2.
- Carroll, Robert L. (2009). The Rise of Amphibians: 365 Million Years of Evolution. Johns Hopkins University Press. ISBN 978-0-8018-9140-3.
- Duellman, William E.; Linda Trueb (1994). Biology of Amphibians. Johns Hopkins University Press. ISBN 978-0-8018-4780-6.
- Duellman, William E., Berg, Barbara (1962), Type Specimens of Amphibians and Reptiles in the Museum of Natural History, the University of Kansas
- Frost, Darrel R.; Grant, Taran; Faivovich, Julián; Bain, Raoul H.; Haas, Alexander; Haddad, Célio F.B.; De Sá, Rafael O.; Channing, Alan; Wilkinson, Mark; Donnellan, Stephen C.; Raxworthy, Christopher J.; Campbell, Jonathan A.; Blotto, Boris L.; Moler, Paul; Drewes, Robert C.; Nussbaum, Ronald A.; Lynch, John D.; Green, David M.; Wheeler, Ward C. (2006). "The Amphibian Tree of Life". Bulletin of the American Museum of Natural History. 297: 1–291. doi:10.1206/0003-0090(2006)297[0001:TATOL]2.0.CO;2. hdl:2246/5781. S2CID 86140137.
- Pounds, J. Alan; Bustamante, Martín R.; Coloma, Luis A.; Consuegra, Jamie A.; Fogden, Michael P. L.; Foster, Pru N.; La Marca, Enrique; Masters, Karen L.; Merino-Viteri, Andrés; Puschendorf, Robert; Ron, Santiago R.; Sánchez-Azofeifa, G. Arturo; Still, Christopher J.; Young, Bruce E. (2006). "Widespread amphibian extinctions from epidemic disease driven by global warming". Nature. 439 (7073): 161–167. Bibcode:2006Natur.439..161A. doi:10.1038/nature04246. PMID 16407945. S2CID 4430672.
- Stuart, Simon N.; Chanson, Janice S.; Cox, Neil A.; Young, Bruce E.; Rodrigues, Ana S. L.; Fischman, Debra L.; Waller, Robert W. (2004). "Status and trends of amphibian declines and extinctions worldwide". Science. 306 (5702): 1783–1786. Bibcode:2004Sci...306.1783S. CiteSeerX 10.1.1.225.9620. doi:10.1126/science.1103538. PMID 15486254. S2CID 86238651.
- Stuart, S. N.; Hoffmann, M.; Chanson, J. S.; Cox, N. A.; Berridge, R. J.; Ramani, P.; Young, B. E., ed. (2008). Threatened Amphibians of the World. Published by Lynx Edicions, in association with IUCN-The World Conservation Union, Conservation International and NatureServe. ISBN 978-84-96553-41-5. Diarsipkan dari asli tanggal October 30, 2014. Diakses tanggal October 30, 2014.
Pranala luar
[sunting | sunting sumber]- Amphibians – AnimalSpot.net
- ArchéoZooThèque : Amphibians skeletons drawings : available in vector, image and PDF formats
- Amphibian Specialist Group
- Amphibian Ark
- AmphibiaWeb
- Global Amphibian Assessment Diarsipkan April 12, 2011, di Wayback Machine.
- Amphibian vocalisations on Archival Sound Recordings Diarsipkan May 26, 2010, di Wayback Machine.
- Articles containing Yunani Kuno-language text
- Artikel dengan pernyataan yang tidak disertai rujukan January 2025
- Artikel dengan pernyataan yang tidak disertai rujukan February 2025
- Pemeliharaan CS1: DOI nonaktif per Juli 2025
- Portal templates with redlinked portals
- Amphibians
- Amphibious organisms
- Extant Late Devonian first appearances
- Taxa named by John Edward Gray






