การตรวจนับเม็ดเลือดอย่างสมบูรณ์
| การตรวจนับเม็ดเลือดอย่างสมบูรณ์ | |
|---|---|
| การวินิจฉัยทางการแพทย์ | |
 ตัวอย่าง CBC หน้าสิ่งพิมพ์ออกซึ่งแสดงผล CBC และการนับแยกชนิดเม็ดเลือด | |
| คำคล้ายกัน | Complete blood cell count,[1] full blood count (FBC),[2] full blood cell count,[3] full blood examination (FBE),[2] hemogram[4] |
| MeSH | D001772 |
| เม็ดไลน์พลัส | 003642 |
| LOINC | Codes for CBC, e.g., 57021-8 |
| HCPCS-L2 | G0306 |
การตรวจนับเม็ดเลือดอย่างสมบูรณ์ (อังกฤษ: complete blood count, CBC หรือ full blood count, FBC) เป็นชุดการตรวจห้องปฏิบัติการทางการแพทย์ที่ให้สารนิเทศเกี่ยวกับเซลล์ในเลือดของบุคคล CBC ระบุจำนวนเม็ดเลือดขาว เม็ดเลือดแดงและเกล็ดเลือด ความเข้มข้นของฮีโมโกลบินและฮีมาโทคริต (ร้อยละปริมาตรของเม็ดเลือดแดง) นอกจากนี้ยังรายงานดัชนีเม็ดเลือดแดง ซึ่งระบุขนาดเฉลี่ยและปริมาณฮีโมโกลบินของเม็ดเลือดแดง และอาจรวมถึงการนับแยกเม็ดเลือดขาว ซึ่งบอกปริมาณเม็ดเลือดขาวชนิดต่าง ๆ
การส่งตรวจ CBC มักเป็นไปเพื่อประกอบการประเมินทางการแพทย์ และสามารถใช้เฝ้าติดตามสุขภาพหรือวินิจฉัยโรคได้ การแปลผลมักใช้การเปรียบเทียบกับพิสัยอ้างอิงซึ่งขึ้นอยู่กับเพศและอายุ ค่าเหล่านี้สามารถนำไปใช้วินิจฉัยโรคบางโรคที่มีนิยามที่อิงจากค่าที่ได้จากการตรวจนับเม็ดเลือดอย่างสมบูรณ์ เช่น ภาวะเลือดจาง และ เกล็ดเลือดน้อย เป็นต้น ดัชนีเม็ดเลือดแดงสามารถให้สารนิเทศเกี่ยวกับสาเหตุของภาวะเลือดจางของบุคคลได้ เช่น การขาดธาตุเหล็กและการขาดวิตามินบี12 และผลการนับแยกเม็ดเลือดขาวสามารถใช้วินิจฉัยการติดเชื้อไวรัส แบคทีเรีย และปรสิต และโรคเลือด เช่น มะเร็งเม็ดเลือดขาว ได้ แต่ทั้งนี้ค่าที่เกินพิสัยอ้างอิงไม่จำเป็นต้องรักษาทางการแพทย์เสมอไป
การทดสอบ CBC ใช้อุปกรณ์ห้องปฏิบัติการพื้นฐานหรือเครื่องวิเคราะห์โลหิตวิทยาอัตโนมัติซึ่งนับเซลล์และเก็บสารนิเทศเกี่ยวกับขนาดและโครงสร้างของเม็ดเลือด เครื่องยังวัดความเข้มข้นของฮีโมโกลบิน และคำนวณดัชนีเม็ดเลือดแดงจากค่าเม็ดเลือดแดงและฮีโลโกลบินที่ได้ นอกจากนี้ยังอาจใช้การตรวจด้วยมือเพื่อยืนยันค่าผิดปกติ ตัวอย่างประมาณร้อยละ 10–25 ต้องยืนยันด้วยฟิล์มเลือด[5] โดยการเกลี่ยป้ายตัวอย่างเลือดและมองผ่านกล้องจุลทรรศน์เพื่อพิสูจน์ยืนยันว่าผลของเครื่องวิเคราะห์สอดคล้องกับลักษณะของเซลล์หรือไม่และเพื่อค้นหาความผิดปกติ ค่าฮีมาโทคริตสามารถหาด้วยมือได้ด้วยการหมุนเหวี่ยงตัวอย่างและวัดสัดส่วนของเม็ดเลือดแดง และในห้องปฏิบัติการที่ไม่มีอุปกรณ์อัตโนมัติ อาจนับเม็ดเลือดได้ภายใต้กล้องจุลทรรศน์โดยใช้ฮีโมไซโทมิเตอร์ (hemocytometer)
ในปี 1852 Karl Vierordt พิมพ์เผยแพร่กระบวนวิธีตรวจนับเม็ดเลือดเป็นครั้งแรก ซึ่งใช้การเกลี่ยเลือดที่ทราบปริมาตรภายใต้สไลด์กล้องจุลทรรศน์และนับเซลล์ทุกเซลล์ ต่อมาในปี 1874 Louis-Charles Malassez ประดิษฐ์ฮีโมไซโทมิเตอร์ซึ่งช่วยให้การวิเคราะห์เม็ดเลือดภายใต้กล้องจุลทรรศน์ง่ายขึ้น ในปลายคริสต์ศตวรรษที่ 19 เพาล์ แอร์ลิช และ Dmitri Leonidovich Romanowsky พัฒนาเทคนิคการย้อมสีเม็ดเลือดขาวและเม็ดเลือดแดงซึ่งยังใช้กันอยู่ในการดูฟิล์มเลือด มีการพัฒนาวิธีการวัดฮีโมโกลบินในคริสต์ทศวรรษ 1920 และ Maxwell Wintrobe ริเริ่มวิธีฮีมาโทคริตวินโทรปในปี 1929 ซึ่งทำให้นิยามดัชนีเม็ดเลือดแดงได้ หลักหมุดในการนับเม็ดเลือดอัตโนมัติ ได้แก่ หลักการ Coulter ซึ่ง Wallace H. Coulter จดสิทธิบัตรในปี 1953 หลักการ Coulter ใช้การวัดอิมพีแดนซ์ไฟฟ้าเพื่อนับเม็ดเลือดและหาขนาดของมัน เป็นเทคโนโลยีที่ยังใช้อยู่ในเครื่องวิเคราะห์หลายชนิด การวิจัยเพิ่มเติมในคริสต์ทศวรรษ 1970 มีการใช้การวัดเชิงแสงเพื่อนับและระบุเซลล์ ซึ่งทำให้เกิดการนับแยกเม็ดเลือดขาวอัตโนมัติ
ความมุ่งหมาย
[แก้]
เลือดประกอบด้วยส่วนของเหลวเรียก พลาสมา และส่วนเซลล์ที่ประกอบด้วยเม็ดเลือดแดง เม็ดเลือดขาวและเกล็ดเลือด[note 1][7] การตรวจนับเม็ดเลือดอย่างสมบูรณ์ใช้ประเมินองค์ประกอบเซลล์ทั้งสามชนิดของเลือด ภาวะทางการแพทย์บางอย่างเช่น ภาวะเลือดจางหรือเกล็ดเลือดต่ำ นิยามว่ามีปริมาณเม็ดเลือดสูงหรือต่ำกว่าปกติ[8] การเปลี่ยนแปลงในระบบอวัยวะหลายอย่างอาจส่งผลต่อเลือด ดังนั้นผล CBC จึงมีประโยชน์ต่อการสอบสวนภาวะต่าง ๆ เนื่องจากการทดสอบนี้ให้สารนิเทศอย่างกว้างขวาง จึงเป็นการทดสอบห้องปฏิบัติการทางการแพทย์ที่ส่งกันแพร่หลายมากเป็นอันดับต้น ๆ[9][10][11]
CBC มักใช้เพื่อคัดกรองโรคโดยเป็นส่วนหนึ่งของการประเมินทางการแพทย์[12] นอกจากนี้อาจส่งตรวจ CBC เมื่อบุคลากรการแพทย์สงสัยว่าบุคคลมีโรคซึ่งส่งผลต่อเม็ดเลือด เช่น ติดเชื้อ การแข็งตัวของเลือดผิดปกติ หรือมะเร็งบางชนิด ผู้ที่ได้รับการวินิจฉัยว่าเป็นโรคที่อาจทำให้ผล CBC ผิดปกติหรือผู้ที่อยู่ระหว่างการรักษาที่อาจส่งผลต่อจำนวนเม็ดเลือดอาจมีการตรวจ CBC เป็นประจำเพื่อเฝ้าติดตามสุขภาพ[4][12] และมักมีการส่งตรวจทุกวันในผู้ป่วยที่รับรักษาในโรงพยาบาล[13] ผลยังอาจบ่งบอกถึงความจำเป็นในการถ่ายเลือดหรือเกล็ดเลือด[14]
การตรวจนับเม็ดเลือดอย่างสมบูรณ์มีการใช้จำเพาะในแพทย์เฉพาะทางหลายสาขา คือ มักทำก่อนผู้ป่วยเข้ารับการผ่าตัดเพื่อตรวจหาภาวะเลือดจาง ตรวจสอบให้แน่ใจว่าระดับเกล็ดเลือดเพียงพอ และตรวจคัดกรองการติดเชื้อ[15][16] รวมทั้งหลังการผ่าตัดเพื่อติดตามการเสียเลือด[12][17] ในวิชาเวชศาสตร์ฉุกเฉิน ใช้ CBC เพื่อสอบสวนอาการหลายอย่าง เช่น ไข้ ปวดท้อง และหายใจลำบาก[18][19][20] และเพื่อประเมินการตกเลือดและการบาดเจ็บ[21][22] มีการติดตามการตรวจนับเม็ดเลือดอย่างใกล้ชิดในผู้ป่วยระหว่างได้รับเคมีบำบัดหรือรังสีบำบัดสำหรับโรคมะเร็ง เนื่องจากการรักษาเหล่านี้จะยับยั้งการผลิตเม็ดเลือดในไขกระดูก และอาจทำให้เกิดระดับการผลิตเม็ดเลือดขาวเกล็ดเลือดและฮีโมโกลบินต่ำรุนแรง[23] การตรวจ CBC เป็นประจำมีความจำเป็นสำหรับผู้ที่รับประทานยาจิตเวชบางชนิดเช่น โคลซาพีนและคาร์บามาเซพีน ซึ่งในกรณีที่หายากอาจทำให้จำนวนเม็ดเลือดขาวลดลงเป็นอันตรายถึงชีวิต (ภาวะแกรนูโลไซต์น้อย)[24][25] ด้วยเหตุว่าภาวะเลือดจางระหว่างตั้งครรภ์อาจส่งผลต่อสุขภาพของมารดาและทารก จึงมีการตรวจ CBC เป็นกิจวัตรในการฝากครรภ์[26] และในทารกแรกคลอด CBC อาจจำเป็นต้องใช้เพื่อสอบสวนภาวะตัวเหลือง หรือใช้นับจำนวนเม็ดเลือดตัวอ่อนในการนับแยกเม็ดเลือดขาว ซึ่งสามารถเป็นตัวบ่งชี้ภาวะพิษเหตุติดเชื้อได้[27][28]
การตรวจนับเม็ดเลือดเป็นเครื่องมือสำคัญในสาขาโลหิตวิทยา ซึ่งศึกษาสาเหตุ การพยากรณ์โรค การรักษาและการป้องกันโรคที่เกี่ยวข้องกับเลือด[29] ผลตรวจ CBC และการตรวจฟิล์มเลือดสะท้อนการทำหน้าที่ของระบบการสร้างเม็ดเลือด (hematopoietic) ซึ่งประกอบด้วยอวัยวะและเนื้อเยื่อซึ่งเกี่ยวข้องกับการผลิตและการเจริญของเม็ดเลือดโดยเฉพาะไขกระดูก[9][30] ตัวอย่างเช่น จำนวนเม็ดเลือดต่ำทั้งสามชนิด (ภาวะพร่องเม็ดเลือดทุกชนิด) อาจบ่งชี้ว่าการผลิตเม็ดเลือดได้รับผลกระทบจากโรคของไขกระดูก และการตรวจไขกระดูกอาจสอบสวนสาเหตุเพิ่มเติมได้[31] เซลล์ที่ผิดปกติบนฟิล์มเลือดอาจบ่งบอกถึง มะเร็งเม็ดเลือดขาวเฉียบพลันหรือมะเร็งต่อมน้ำเหลือง ขณะที่จำนวนนิวโทรฟิลหรือลิมโฟไซต์สูงผิดปกติร่วมกับอาการบ่งชี้และสิ่งตรวจพบในฟิล์มเลือดอาจทำให้สงสัยว่าเป็นโรค myeloproliferative หรือ lymphoproliferative การตรวจผล CBC และฟิล์มเลือดสามารถช่วยแยกสาเหตุของโรคโลหิตจางได้ เช่น โรคโภชนาการ ความผิดปกติของไขกระดูก ภาวะเลือดจางจากการสลายของเม็ดเลือดที่เกิดภายหลัง และโรคถ่ายทอดทางพันธุกรรม เช่น โรคเลือดจางเม็ดเลือดแดงรูปเคียว และทาลัสซีเมีย[32][33]
พิสัยอ้างอิงสำหรับการตรวจนับเม็ดเลือดอย่างสมบูรณ์เป็นพิสัยค่าที่พบในบุคคลที่ดูมีสุขภาพดีร้อยละ 95[note 2][35] จากนิยามนี้ ผลลัพธ์ร้อยละ 5 จะอยู่นอกพิสัยนี้เสมอ ดังนั้นผลลัพธ์ผิดปกติบางอย่างอาจสะท้อนความหลากหลายตามธรรมชาติไม่ใช่ปัญหาการแพทย์[36] ซึ่งมีโอกาสเป็นไปได้อย่างยิ่งหากผลลัพธ์ดังกล่าวอยู่เลยพิสัยอ้างอิงเพียงเล็กน้อย ไม่ต่างจากผลลัพธ์รอบก่อน ๆ หรือไม่มีความผิดปกติอื่นที่สัมพันธ์กันที่แสดงใน CBC[37] เมื่อทดสอบกับประชากรที่มีสุขภาพค่อนข้างดี จำนวนความผิดปกติที่ไม่มีนัยสำคัญทางคลินิกอาจมากเกินจำนวนผลลัพธ์ที่แสดงถึงโรค[38] ด้วยเหตุนี้องค์การวิชาชีพในสหรัฐ สหราชอาณาจักรและแคนาดาจึงไม่แนะนำให้ทดสอบ CBC ก่อนการผ่าตัดที่มีความเสี่ยงต่ำในผู้ที่ไม่มีภาวะทางการแพทย์ที่เกี่ยวข้อง[15][39][40] การเจาะเลือดซ้ำ ๆ เพื่อตรวจทางโลหิตวิทยาในผู้ป่วยที่เข้ารับการรักษาในโรงพยาบาลอาจมีส่วนต่อภาวะเลือดจางในโรงพยาบาล และการถ่ายเลือดโดยไม่จำเป็น[38]
ขั้นตอน
[แก้]เริ่มจากการเก็บตัวอย่างโดยเจาะเลือดใส่เข้าไปในหลอดบรรจุเลือดที่หล่อสารต้านการจับลิ่มของเลือด ซึ่งส่วนใหญ่ใช้ EDTA เพื่อหยุดการจับลิ่มของเลือดตามธรรมชาติ[41] โดยปกติจะดึงเลือดจากหลอดเลือดดำ แต่ถ้ายากเกินไปอาจเก็บจากหลอดเลือดฝอยด้วยการเจะเลือดปลายนิ้วหรือส้นเท้าในทารกได้[42][43] โดยทั่วไปการทดสอบใช้เครื่องวิเคราะห์อัตโนมัติ แต่อาจใช้เทคนิคด้วยมือ เช่น การตรวจฟิล์มเลือดหรือการทดสอบฮีมาโทคริตด้วยมือ เพื่อสอบสวนผลลัพธ์ที่ผิดปกติ[44] การนับจำนวนเม็ดเลือดและการวัดฮีโมโกลบินใช้วิธีด้วยมือในห้องปฏิบัติการที่ไม่มีเครื่องมืออัตโนมัติ[45]
วิธีอัตโนมัติ
[แก้]บนเครื่องวิเคราะห์ จะมีการเขย่าตัวอย่างเพื่อกระจายเม็ดเลือดให้สม่ำเสมอ จากนั้นจะมีการเจือจางและแบ่งออกเป็นอย่างน้อยสองช่อง ช่องหนึ่งใช้ในการนับเม็ดเลือดแดงและเกล็ดเลือด อีกช่องหนึ่งเพื่อนับเม็ดเลือดขาวและหาความเข้มข้นของฮีโมโกลบิน เครื่องมือบางอย่างวัดค่าฮีโมโกลบินในช่องแยกต่างหาก และอาจใช้ช่องเพิ่มอีกในการนับแยกชนิดเม็ดเลือดขาว เรติคูโลไซต์ และการตรวจวัดเกล็ดเลือดเป็นพิเศษ[46][47][48] เม็ดเลือดถูกแขวนลอยในกระแสของไหลและจะวัดคุณสมบัติของเม็ดเลือดขณะที่ไหลผ่านตัวรับรู้ในเทคนิคที่เรียก โฟลไซโทเมทรี (flow cytometry)[note 3][49][52] การโฟกัสอุทกพลศาสตร์ (hydrodynamic focusing) อาจใช้เพื่อแยกเม็ดเลือดโดด ๆ เพื่อให้ได้ผลลัพธ์แม่นยำยิ่งขึ้น ตัวอย่างเจือจางจะถูกฉีดเข้าสู่กระแสของไหลความดันต่ำ ซึ่งทำให้เม็ดเลือดในตัวอย่างเรียงแถวเดี่ยวผ่านการไหลแบบแลมินาร์[53][54]

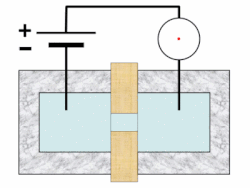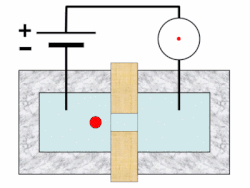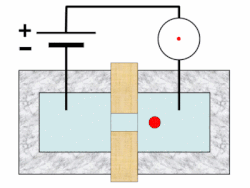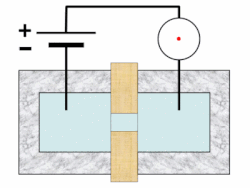
ในการวัดความเข้มข้นของฮีโมโกลบิน มีการเพิ่มสารเคมีตัวทำปฏิกิริยาลงในตัวอย่างเพื่อสลายเม็ดเลือดแดงในช่องแยกต่างหากจากช่องที่ใช้นับจำนวนเม็ดเลือดแดง ในเครื่องวิเคราะห์ที่นับเม็ดเลือดขาวในช่องเดียวกับวัดฮีโมโกลบินนั้น วิธีนี้ยังช่วยทำให้นับเม็ดเลือดขาวได้ง่ายขึ้นอีกด้วย[55] เครื่องวิเคราะห์โลหิตวิทยาวัดฮีโมโกลบินโดยใช้การวัดความเข้มของแสง (spectrophotometry) และอาศัยความสัมพันธ์เชิงเส้นระหว่างความดูดกลืนรังสี (absorbance) ของแสงและปริมาณฮีโมโกลบินที่มีอยู่ มีการใช้สารเคมีเพื่อแปลงฮีโมโกลบินรูปต่าง ๆ เช่น อ็อกซีฮีโมโกลบินและคาร์บ็อกซีฮีโมโกลบิน ให้อยู่ในรูปเสถียรรูปเดียว ซึ่งปกติเป็นไซแอนเมทฮีโมโกลบิน และเพื่อสร้างการเปลี่ยนสีอย่างถาวร ความดูดกลืนรังสีของสีที่ได้นั้น เมื่อวัดที่ความยาวคลื่นเฉพาะ (ปกติใช้ 540 นาโนเมตร) จะสอดคล้องกับความเข้มข้นของฮีโมโกลบิน[56][57]
ตัวรับรู้จะนับและระบุเม็ดเลือดในตัวอย่างโดยใช้หลักการสำคัญ 2 ประการ ได้แก่ อิมพีแดนซ์ไฟฟ้า และการกระเจิงของแสง[58] การนับเม็ดเลือดวิธีอิงอิมพีแดนซ์ใช้หลักการโคลเตอร์ คือ เม็ดเลือดจะถูกแขวนลอยในของไหลที่พากระแสไฟฟ้าขนาดหนึ่ง และเมื่อเม็ดเลือดไหลผ่านช่องเปิดขนาดเล็ก (รู) จะทำให้กระแสลดลงเนื่องจากสภาพนำไฟฟ้าไม่ดีเท่า แอมพลิจูดของพัลส์แรงดันไฟฟ้าที่ผลิตขึ้นเมื่อเม็ดเลือดข้ามรูนั้นมีความสัมพันธ์กับปริมาณของไหลที่ถูกแทนที่โดยเม็ดเลือด ซึ่งเท่ากับปริมาตรของมัน[59][60] ขณะที่จำนวนพัลส์ทั้งหมดสัมพันธ์กับจำนวนเม็ดเลือดในตัวอย่าง จะมีการลงการกระจายของปริมาตรเม็ดเลือดบนฮิสโตแกรม และโดยการตั้งค่าขีดเริ่มเปลี่ยนตามขนาดตรงแบบของเม็ดเลือดแต่ละชนิด จะทำให้สามารถแยกแยะและนับประชากรเม็ดเลือดชนิดต่าง ๆ ได้[61]
ในเทคนิคการกระเจิงแสง แสงจากเลเซอร์หรือหลอดทังสเตน-ฮาโลเจนจะถูกส่งไปที่กระแสของเม็ดเลือดเพื่อรวบรวมสารนิเทศเกี่ยวกับขนาดและโครงสร้างของพวกมัน เม็ดเลือดทำให้แสงกระเจิงในมุมที่ต่างกันขณะผ่านลำแสงซึ่งตรวจจับได้โดยใช้โฟโตมิเตอร์ การกระเจิงไปด้านหน้าซึ่งหมายถึงปริมาณแสงที่กระเจิงตามแกนของลำแสงนั้น ส่วนใหญ่เกิดจากการเลี้ยวเบนของแสงและสัมพันธ์กับขนาดของเซลล์ ในขณะที่การกระเจิงด้านข้าง (แสงกระเจิงที่มุม 90 องศา) เกิดจากการสะท้อนและการหักเห และให้สารนิเทศเกี่ยวกับความซับซ้อนของเซลล์[62][63]
วิธีที่อาศัยความถี่วิทยุสามารถใช้ร่วมกับอิมพีแดนซ์ได้ เทคนิคเหล่านี้ทำงานบนหลักการเดียวกันในการวัดการขัดจังหวะของกระแสเมื่อเซลล์ผ่านรู แต่ด้วยเหตุที่กระแสความถี่วิทยุความถี่สูงทะลวงเข้าสู่เม็ดเลือด แอมพลิจูดของพัลส์ที่ได้จึงสัมพันธ์กับขนาดโดยสัมพัทธ์ของนิวเคลียส โครงสร้างของนิวเคลียส และจำนวนของแกรนูลในไซโทพลาซึม[64][65] เม็ดเลือดแดงและเศษเซลล์ซึ่งมีขนาดใกล้เคียงกับเกล็ดเลือดอาจรบกวนการนับเกล็ดเลือด และอาจนับเกล็ดเลือดขนาดใหญ่ได้ไม่ถูกต้อง ดังนั้นเครื่องวิเคราะห์บางส่วนจึงใช้เทคนิคเพิ่มเติมในการวัดเกล็ดเลือด เช่น การย้อมสีฟลูออเรสเซนต์ กาารกระเจิงของแสงหลายมุม และการติดป้ายระบุสารภูมิต้านทานโมโนโคลน[48]

เครื่องวิเคราะห์ส่วนใหญ่วัดขนาดเฉลี่ยของเม็ดเลือดแดงโดยตรง เรียก ปริมาตรของเม็ดเลือดแดงโดยเฉลี่ย (mean cell volume, MCV) และคำนวณฮีมาโทคริตโดยคูณปริมาณเม็ดเลือดแดงกับ MCV บางเครื่องวัดฮีมาโทคริตโดยการเปรียบเทียบปริมาตรทั้งหมดของเม็ดเลือดแดงกับปริมาตรของตัวอย่างเลือด และหาค่า MCV จากฮีมาโทคริตและจำนวนเม็ดเลือดแดง[66] ความเข้มข้นของฮีโมโกลบิน จำนวนเม็ดเลือดแดงและฮีมาโทคริตนำมาใช้คำนวณปริมาณเฉลี่ยของฮีโมโกลบินในเม็ดเลือดแดง (mean corpuscular hemoglobin, MCH) และความเข้มข้นเฉลี่ยของฮีโมโกลบินในเม็ดเลือดแดง (mean corpuscular hemoglobin concentration, MCHC)[67] การคำนวณอีกค่าหนึ่ง คือ ความกว้างของการกระจายขนาดเม็ดเลือดแดง (red blood cell distribution width, RDW) นั้นได้มาจากส่วนเบี่ยงเบนมาตรฐานของปริมาตรเม็ดเลือดเฉลี่ยและสะท้อนถึงความแปรผันของขนาดเม็ดเลือด[68]
หลังใส่ตัวทำปฏิกิริยาแล้ว เม็ดเลือดขาวจะก่อตัวเป็นจุดสูงสุดสามจุดเมื่อมีการลงกราฟบนฮิสโตแกรม ยอดเหล่านี้สอดคล้องกับประชากรแกรนูโลไซต์ ลิมโฟไซต์ และเซลล์นิวเคลียสเดียวอย่างอื่น ทำให้การนับแยก 3 ส่วนสามารถวัดได้จากปริมาตรเซลล์เพียงอย่างเดียว[69][70] เครื่องวิเคราะห์ขั้นสูงขึ้นใช้เทคนิคเพิ่มเติมเพื่อนับแยกเม็ดเลือด 5 ถึง 7 ชนิด เช่น การกระเจิงของแสงหรือการวิเคราะห์ความถี่วิทยุ[70] หรือการใช้สีย้อมเพื่อย้อมสารเคมีเฉพาะภายในเซลล์ ตัวอย่างเช่น กรดนิวคลีอิก ซึ่งจะพบความเข้มข้นสูงกว่าในเม็ดเลือดที่ยังเจริญไม่เต็มวัย[71] หรือไมอีโลเพอร็อกซีเดส ซึ่งเป็นเอนไซม์ที่พบในเม็ดเลือดสายไมอีลอยด์[72][73] เบโซฟิลอาจนับในช่องแยกเมื่อตัวทำปฏิกิริยาทำลายเม็ดเลือดขาวอื่น ๆ คงเหลือเบโซฟิลไว้ ข้อมูลที่เก็บจากากรวัดเหล่านี้จะมีการวิเคราะหและลงจุดบนสแกตเตอร์แกรม (scattergram) ซึ่งจะก่อรูปเป็นกลุ่มที่มีความสัมพันธ์กับเม็ดเลือดขาวแต่ละชนิด[70][72] อีกวิธีหนึ่งในการนับแยกชนิดเม็ดเลือดอัตโนมัติ คือ การใช้ซอฟต์แวร์กล้องจุลทรรศน์ดิจิทัล[74] ซึ่งใช้ปัญญาประดิษฐ์ในการจำแนกเม็ดเลือดขาวจากภาพถ่ายฟิล์มเลือดจากกล้องจุลทรรศน์ ภาพเม็ดเลือดจะแสดงต่อผู้ควบคุมกล้อง ซึ่งสามารถจำแนกเม็ดเลือดใหม่ด้วยมือได้ถ้าจำเป็น[75]
เครื่องวิเคราะห์ส่วนใหญ่ใช้เวลาไม่ถึง 1 นาทีในการทดสอบทั้งหมดในการตรวจนับเม็ดเลือดอย่างสมบูรณ์[58] เนื่องจากเครื่องวิเคราะห์สุ่มตัวอย่างและนับเม็ดเลือดเดี่ยว ๆ จำนวนมาก ผลลัพธ์จึงมีความแม่นยำสูง[76] อย่างไรก็ดี เม็ดเลือดผิดปกติอาจจำแนกได้อย่างไม่ถูกต้อง ทำให้ต้องมีการทบทวนผลที่ได้จากเครื่องด้วยมือ และการระบุชนิดของเม็ดเลือดผิดปกติด้วยวิธีอื่นที่เครื่องจำแนกไม่ได้[5][77]
การทดสอบ ณ จุดดูแลผู้ป่วย
[แก้]การทดสอบ ณ จุดดูแลผู้ป่วย (point-of-care) เป็นการทดสอบนอกที่ตั้งห้องปฏิบัติการ เช่น ข้างเตียงผู้ป่วยหรือในคลินิก[78][79] วิธีการทดสอบนี้รวดเร็วกว่าและใช้เลือดน้อยกว่าวิธีเดิม อีกทั้งไม่ต้องอาศัยบุคลากรที่ผ่านการฝึกฝนแบบเฉพาะ จึงมีประโยชน์ในสถานการณ์ฉุกเฉินและในพื้นที่ที่เข้าถึงทรัพยากรอย่างจำกัด อุปกรณ์ที่ใช้กันทั่วไปสำหรับการทดสอบโลหิตวิทยา ณ จุดดูแลผู้ป่วย ประกอบด้วย HemoCue เครืองวิเคราะห์แบบพกพาที่ใช้การวัดความเข้มของแสง (spectrophotometry) เพื่อวัดความเข้มข้นของฮีโมโกลบินตัวอย่าง และ i-STAT ซึ่งหาค่าฮีโมโกลบินโดยการกะประมาณความเข้มข้นของเม็ดเลือดแดงจากสภาพนำของเลือด[79] ฮีโมโกลบินและฮีมาโทคริตสามารถวัดได้โดยอุปกรณ์ ณ จุดดูแลผู้ป่วยที่ออกแบบมาเพื่อการทดสอบแก๊สในเลือด (blood gas testing) แต่การวัดเหล่านี้บางทีมีความสัมพันธืที่เลวเมื่อเทียบกับการวัดจากวิธีมาตรฐาน[78] นอกจากนี้มีเครื่องวิเคราะห์โลหิตวิทยาอย่างง่ายซึ่งออกแบบมาสำหรับใช้ในคลนิกที่สามารถตรวจนับเม็ดเลือดอย่างสมบูรณ์และนับแยกชนิดเม็ดเลือดได้[80]
วิธีมือ
[แก้]
การทดสอบด้วยวิธีมือก็สามารถใช้ได้เมื่อไม่มีหรืออุปกรณ์อัตโนมัติไม่พร้อมใช้งาน หรือเมื่อผลเครื่องวิเคราะห์บ่งชี้ว่ามีความจำเป็นต้องทดสอบเพิ่มเติม[45] มีการบ่งชี้ว่าผลลัพธ์อัตโนมัติต้องมีการทบทวนฟิล์มเลือดด้วยมือในผู้ป่วยร้อยละ 10–25 ซึ่งอาจเนื่องจากมีประชากรเม็ดเลือดผิดปกติว่าเครื่องวิเคราะห์ไม่สามารถนับได้อย่างเหมาะสม[5] ตัวบ่งชี้ภายในที่ผลิตขึ้นโดยเครื่องวิเคราะห์ที่เสนอว่าผลลัพธ์อาจไม่แม่นยำ[81] หรือผลลัพธ์ที่เป็นตัวเลขที่อยู่นอกเกณฑ์ที่ตั้งไว้[77] ในการสอบสวนปัญหาเหล่านี้ จะมีการเกลี่ยเลือดบนสไลด์กล้องจุลทรรศน์ ย้อมด้วยสีย้อม Romanowsky และตรวจภายใต้กล้องจุลทรรศน์[82] มีการประเมินลักษณะปรากฏของเม็ดเลือดแดง เม็ดเลือดขาวและเกล็ดเลือด และจะมีรายงานความผิดปกติของปริมาณถ้ามี[83] การเปลี่ยนแปลงลักษณะเม็ดเลือดแดงอาจมีความสำคัญในเชิงวินิจฉัยพอสมควร ตัวอย่างเช่น การมีโรคเม็ดเลือดแดงรูปเคียว และการมีเศษเม็ดเลือดแดงจำนวนมาก (schistocyte) จำเป็นต้องอาศัยการสืบสวนอย่างเร่งด่วนดังที่สามารถเสนอแนะภาวะเลือดจางจากการสลายของเม็ดเลือดแดงเหตุโรคหลอดเลือดฝอย (microangiopathic hemolytic anemia)[84] ในภาวะการอักเสบบางอย่างและในโรคพาราโปรตีนอย่างโรคมะเร็งเม็ดเลือดขาวชนิดมัยอิโลมา (multiple myeloma) โปรตีนระดับสูงในเลือดอาจทำให้เม็ดเลือดแดงดูเหมือนซ้อนกันบนฟิล์มเลือด เรียกว่า รูโล (rouleaux)[85] โรคปรสิตบางชนิด เช่น มาลาเรีย และบาบีซิโอซิส (babesiosis) สามารถตรวจหาได้โดยการหาจุลชีพก่อโรคบนฟิล์มเลือด[86] และปริมาณเกล็ดเลือดสามารถกะประมาณได้จากฟิล์มเลือด ซึ่งมีประโยชน์ถ้าปริมาณเกล็ดเลือดที่วัดด้วยวิธีอัตโนมัติไม่แม่นยำ[77]
ในการนับแยกชนิดเม็ดเลือดขาวด้วยมือ ผู้ทดสอบกล้องจุลทรรศน์นับเม็ดเลือด 100–200 เม็ดบนฟิล์มเลือดและจำแนกตามลักษณะที่ปรากฏ[87] การทดสอบนี้จะบอกร้อยละของเม็ดเลือดขาวแต่ละชนิด และเมื่อคูณร้อยละกับจำนวนเม็ดเลือดขาวทั้งหมดจะได้จำนวนสัมบูรณ์ของเม็ดเลือดขาวแต่ละชนิด[88] การนับด้วยมืออาจมีข้อผิดพลาดในการสุ่มตัวอย่างเพราะนับเม็ดเลือดได้น้อยเมื่อเทียบกับการวิเคราะห์อัตโนมัติ[76] แต่วิธีนี้สามารถระบุเม็ดเลือดผิดปกติได้แต่เครื่องวิเคราะห์ทำไม่ได้[72][77] เช่น เม็ดเลือดวัยอ่อนในมะเร็งเม็ดเลือดขาวเฉียบพลัน[89] ลักษณะที่มีความสำคัญทางคลินิก เช่น แกรนูลพิษ (toxic granulation) และการมีช่องว่าง (granulation) ก็ยังสามารถบอกได้จากการดูเม็ดเลือดขาวในกล้องจุลทรรศน์[90]
การหาฮีมาโทคริตวิธีมือกระทำโดยใส่เลือดลงในหลอดฝอย ปั่นเหวี่ยง และวัดร้อยละของเลือดที่ประกอบด้วยเม็ดเลือดแดง[66] วิธีนี้มีประโยชน์ในบางภาวะที่ผลฮีมาโทคริตวิธีอัตโนมัติไม่ถูกต้อง เช่น ภาวะเม็ดเลือดแดงมาก[66] หรือภาวะเม็ดเลือดขาวมากรุนแรง ซึ่งขัดขวางการวัดเม็ดเลือดแดงเพราะนับเม็ดเลือดขาวผิดเป็นเม็ดเลือดแดง[91]
การนับเม็ดเลือดแดง เม็ดเลือดขาวและเกล็ดเลือดสามารถใช้ฮีโมไซโทมิเตอร์ (hemocytometer) ซึ่งเป็นสไลด์กล้องจุลทรรศน์ที่มีห้องที่ใส่เลือดเจือจางในปริมาตรตามที่ระบุ ห้องของฮีโมไซโทมิเตอร์ถูกพิมพ์กัดกรด (etch) ด้วยตาตารางที่ปรับพิกัดแล้วเพื่อช่วยในการนับ ผู้ทดสอบจะนับเม็ดเลือดที่เห็นในตาตารางและหารด้วยปริมาตรของเลือดที่ตรวจ ซึ่งมาจากจำนวนช่องสี่เหลี่ยมที่นับได้บนตาตาราง เพื่อหาความเข้มข้นของเม็ดเลือดในตัวอย่าง[45][92] การนับเม็ดเลือดด้วยวิธีมือนั้นใช้แรงงานมากและไม่แม่นยำเมื่อเทียบกับวิธีอัตโนมัติ ฉะนั้นจึงแทบไม่มีใช้นอกเหนือจากห้องปฏิบัติการที่ไม่มีเครื่องนับอัตโนมัติ[45][92] ในการนับเม็ดเลือด จะมีการเจือจางตัวอย่างโดยใช้ของเหลวที่มีสารประกอบให้เกิดการสลายของเม็ดเลือดแดง เช่น แอมโมเนียมอ็อกซาเลต กรดอะซิติก หรือกรดไฮโดรคลอริก[93] บางทีอาจใส่สีย้อมลงในเลือดเจือจางด้วยเพื่อเน้นสีนิวเคลียสของเม็ดเลือดขาวซึ่งจะทำให้ระบุได้ง่ายขึ้น การนับจำนวนเกล็ดเลือดด้วยวิธีมือก็ใช้วิธีการคล้ายกัน แต่บางวิธียังคงให้เม็ดเลือดแดงสมบูรณ์อยู่ การใช้กล้องจุลทรรศน์วัฏภาค (phase-contrast) แทนกล้องจุลทรรศน์แบบใช้แสง สามารถทำให้หาเกล็ดเลือดได้ง่ายขึ้น[94] สำหรับการนับจำนวนเม็ดเลือดแดง้ดวยวิธีนั้นมีปฏิบัติน้อย เพราะไม่แม่นยำ และมีวิธีอื่นสำหรับประเมินเม็ดเลือดแดงอยู่แล้ว เช่น การวัดฮีโมโกลบิน (hemoglobinometry) และฮีมาโทคริตด้วยมือ แต่ถ้ามีความจำเป็น อาจใช้วิธีนับเม็ดเลือดแดงในเลือดที่เจือจางด้วยน้ำเกลือได้[95]
ฮีโมโกลบินอาจวัดได้ด้วยมือโดยใช้เครื่องวัดความเข้มแสง (spectrophotometer) หรือมาตรเทียบสี (colorimeter) ในการวัดฮีโมโกลบินด้วยมือ เริ่มจากเจือจางตัวอย่างด้วยตัวทำปฏิกิริยาเพื่อสลายเม็ดเลือดแดงและปล่อยฮีโมโกลบินออกมา มีการใช้สารเคมีอย่างอื่นเพื่อแปลงฮีโมโกลบินรูปต่าง ๆ ให้อยู่ในรูปเดียวกัน ทำให้ง่ายต่อการวัด จากนั้นจะวางสารละลายในคิวเว็ตใช้วัดและจะมีการวัดความดูดกลืนรังสีที่ความยาวคลื่นหนึ่ง ขึ้นอยู่กับชนิดตัวทำปฏิกิริยาที่ใช้ มาตรฐานอ้างอิงจะมีปริมาณฮีโมโกลบินที่ทราบเพื่อหาความสัมพันธ์ระหว่างความดูดกลืนรังสีกับความเข้มข้นของฮีโมโกลบิน ซึ่งจะทำให้เทียบหาค่าฮีโมโกลบินในตัวอย่างได้[96]
ในพื้นที่ชนบทและพื้นที่ด้อยโอกาสทางเศรษฐกิจ การทดสอบที่มีอยู่จะถูกจำกัดโดยการเข้าถึงอุปกรณ์และบุคลากร ที่สถานบริการปฐมภูมิในภูมิภาคเหล่านี้ การทดสอบอาจจำกัดเฉพาะการตรวจสัณฐานวิทยาของเม็ดเลือดแดงและการวัดฮีโมโกลบินด้วยมือ ในขณะที่เทคนิคที่ซับซ้อนมากขึ้น เช่น การนับจำนวนและแยกชนิดด้วยมือ และบางทีการนับเม็ดเลือดอัตโนมัติ จะต้องกระทำที่ห้องปฏิบัติการระดับเขตหรืออำเภอ โรงพยาบาลส่วนภูมิภาคและโรงพยาบาลประจำจังหวัดหรือมณฑล และศูนย์วิชาการตรงแบบเข้าถึงเครื่องวิเคราะห์อัตโนมัติ สำหรับในพื้นที่ที่ไม่มีแม้ห้องปฏิบัติการ สามารถประมาณความเข้มข้นของฮีโมโกลบินลงในกระดาษซับชนิดมาตรฐานและเปรียบเทียบกับมาตราสี[97]
กาควบคุมคุณภาพ
[แก้]เครื่องวิเคราะห์อัตโนมัติจำเป็นต้องปรับพิกัดเป็นประจำ ผู้ผลิตส่วนใหญ่ให้เลือดที่เก็บรักษาไว้ซึ่งมีพารามิเตอร์ตามที่นิยามและจะมีการปรับแต่งเครื่องวิเคราะห์ถ้าผลลัพธ์อยู่นอกขีดเริ่มเปลี่ยนที่นิยามไว้[98] เพื่อรับประกันว่าตัวอย่างจะแม่นยำต่อไป ตัวอย่างควบคุมคุณภาพซึ่งตรงแบบผู้ผลิตอุปกรณ์จะจัดเตรียมให้ จะมีการทดสอบอย่างน้อยวันละครั้ง ตัวอย่างดังกล่าวถูกจัดทำขึ้นเพื่อให้มีผลลัพธ์เฉพาะ และห้องปฏิบัติการจะเปรีบยเทียบผลกับค่าที่ทราบเพื่อให้แน่ใจว่าอุปกรณ์ทำงานอย่างเหมาะสม[99][100] สำหรับห้องปฏิบัติการที่เข้าไม่ถึงวัสดุควบคุมคุณภาพพาณิชย์ องค์การข้อบังคับในประเทศอินเดียแห่งหนึ่งแนะนำให้ตรวจตัวอย่างผู้ป่วยซ้ำแล้วเปรียบเทียบกัน[101] การวัดค่าเฉลี่ยเคลื่อนที่ ซึ่งเป็นการวัดผลเฉลี่ยสำหรับตัวอย่างผู้ป่วยที่ช่วงห่างที่กำหนดไว้ สามารถใช้เป็นเทคนิคควบคุมคุณภาพเพิ่มเติม เมื่อสันนิษฐานว่าลักษณะของประชากรผู้ป่วยไม่ค่อยเปลี่ยนแปลงตามเวลา ค่าเฉลี่ยจึงควรคงที่ด้วย ค่าที่เปลี่ยนไปมากจากค่าเฉลี่ยอาจบ่งบอกว่าเครื่องมีปัญหา[99][100] ค่า MCHC มีประโยชน์เป็นพิเศษในแง่นี้[102]
นอกเหนือจากการวิเคราะห์ตัวอย่างควบคุมคุณภาพภายในด้วยผลลัพธ์ที่ทราบแล้ว ห้องปฏิบัติการอาจได้รับตัวอย่างการประเมินคุณภาพภายนอกจากองค์การข้อบังคับ แม้ว่าจุดประสงค์ของการควบคุมคุณภาพภายในคือเพื่อประกันว่าผลของเครื่องวิเคราะห์สามารถทำซ้ำได้ในห้องปฏิบัติการหนึ่ง ๆ แต่การประเมินคุณภาพภายนอกจะตรวจสอบว่าผลลัพธ์จากห้องปฏิบัติการต่างที่กันมีความสอดคล้องซึ่งกันและกันและเป็นไปตามค่าเป้าหมายหรือไม่[103] ผลที่คาดหมายสำหรับตัวอย่างประเมินคุณภาพภายนอกจะไม่เปิดเผยต่อห้องปฏิบัติการ[104] โปรแกรมการประเมินคุณภาพภายนอกได้รับการยอมรับอย่างกว้างขวางในทวีปอเมริกาเหนือและยุโรปตะวันตก[99] และห้องปฏิบัติการมักต้องเข้าร่วมในโปรแกรมเหล่านี้เพื่อคงการรับรองคุณภาพต่อไป[105] ปัญหาด้านลอจิสติกส์อาจทำให้ห้องปฏิบัติการในพื้นที่ที่มีทรัพยากรไม่เพียงพอปฏิบัติตามแผนสำหรับประเมินคุณภาพภายนอก[106]
การทดสอบที่รวมอยู่ด้วย
[แก้]CBC วัดจำนวนเกล็ดเลือด เม็ดเลือดแดงและเม็ดเลือดขาว ร่วมกับฮีโมโกลบินและฮีมาโทคริต สำหรับดัชนีเม็ดเลือดแดง (MCV, MCH และ MCHC) ซึ่งอธิบายขนาดเม็ดเลือดแดงและปริมาณฮีโมโกลบิน รายงานพร้อมกับความกว้างการกระจายของเม็ดเลือดแดง (RDW) ซึ่งวัดปริมาณความหลากหลายของขนาดเม็ดเลือดแดง และอาจรวมทั้งการนับแยกเม็ดเลือดขาวซึ่งแจงนับเม็ดเลือดขาวชนิดต่าง ๆ และจำนวนเม็ดเลือดแดงที่ยังไม่เต็มวัย (เรติคูโลไซต์)[4][107]
เม็ดเลือดแดง ฮีโมโกลบินและฮีมาโทคริต
[แก้]| สารที่วิเคราะห์ | ผลลัพธ์ | พิสัยปกติ |
|---|---|---|
| เม็ดเลือดแดง | 5.5 x 1012/L | 4.5–5.7 |
| เม็ดเลือดขาว | 9.8 x 109/L | 4.0–10.0 |
| ฮีโมโกลบิน | 123 g/L | 133–167 |
| ฮีมาโทคริต | 0.42 | 0.35–0.53 |
| MCV | 76 fL | 77–98 |
| NCH | 22.4 pg | 26–33 |
| MCHC | 293 g/L | 330–370 |
| RDW | 14.5% | 10.3–15.3 |
เม็ดเลือดแดงลำเลียงออกซิเจนจากปอดไปยังเนื้อเยื่อ และขากลับจะนำคาร์บอนไดออกไซด์กลับสู่ปอดแล้วกำจัดโดยการหายใจออก หน้าที่เหล่านี้มีฮีโมโกลบินในเม็ดเลือดแดงเป็นสื่อกลาง[109] เครื่องวิเคราะห์จะนับเม็ดเลือดแดงรายงานผลในหน่วย 106 เซลล์ต่อไมโครลิตรของเลือด (× 106/μL) หรือ 1012 เซลล์ต่อลิตร (× 1012/L) และวัดขนาดเฉลี่ยซึ่งเรียก ปริมาตรเม็ดเลือดโดยเฉลี่ย และแสดงในหน่วยเฟมโตลิตรหรือลูกบาศก์ไมโครเมตร[4] ค่าฮีมาโทคริต (HCT) หรือปริมาตรเลือดแดง (PCV) อาจได้จากการคำนวณปริมาตรเม็ดเลือดโดยเฉลี่ยกับจำนวนเม็ดเลือดแดง[66] และเมื่อทำการตรวจฮีมาโทคริตโดยตรงปริมาณเซลล์เฉลี่ยอาจคำนวณได้จากฮีมาโทคริตและจำนวนเม็ดเลือดแดง [110][111] สำหรับฮีโมโกลบินที่วัดได้หลังจากการสลายเม็ดเลือดแด มักรายงานเป็นหน่วยกรัมต่อลิตร (g/L) หรือกรัมต่อเดซิลิตร (g/dL)[112] สมมติว่าปริมาณเม็ดเลือดแดงปกติ มีความสัมพันธ์คงที่ระหว่างฮีโมโกลบินและฮีมาโทคริตดังนี้ ร้อยละฮีมาโทคริตสูงกว่าค่าฮีโมโกลบินในหน่วย g/dL ประมาณสามเท่า บวกลบสาม ความสัมพันธ์นี้เรียกว่า กฎสาม (rule of three) ซึ่งสามารถใช้เพื่อยืนยันว่าผลลัพธ์ CBC ถูกต้องหรือไม่[113]
การวัดอีกสองอย่างได้มาจากการคำนวณจำนวนเม็ดเลือดแดง ความเข้มข้นของฮีโมโกลบินและฮีมาโทคริต ได้แก่ ปริมาตรของเม็ดเลือดแดงโดยเฉลี่ย (MCV) และปริมาณเฉลี่ยของฮีโมโกลบินในเม็ดเลือดแดง (MCH)[114][115] พารามิเตอร์เหล่านี้อธิบายปริมาณฮีโมโกลบินในเม็ดเลือดแดง 1 เม็ดเลือด MCH และ MCHC อาจชวนให้สับสนได้ แต่สาระสำคัญคือ MCH เป็นการวัดปริมาณฮีโมโกลบินเฉลี่ยต่อเม็ดเลือดแดง 1 เม็ดเลือด MCHC บอกสัดส่วนเฉลี่ยของเม็ดเลือดที่เป็นฮีโมโกลบิน MCH ไม่คำนึงถึงขนาดของเม็ดเลือดแดง ซึ่งตรงข้ามกับ MCHC[116] MCV, MCH, และ MCHC เรียกรวมกันว่า ดัชนีเม็ดเลือดแดง[114][115] ค่าดัชนีที่เปลี่ยนแปลงจะสังเกตได้บนฟิล์มเลือด คือ เม็ดเลือดแดงที่มีขนาดใหญ่หรือเล็กกว่าปกติจะบอกได้โดยเปรียบเทียบกับขนาดของเม็ดเลือดขาว และเม็ดเลือดที่มีความเข้มข้นของฮีโมโกลบินต่ำจะดูสีซีด[117] พารามิเตอร์อีกค่าหนึ่งคำนวณจากการวัดเม็ดเลือดแดงในคราวแรก ได้แก่ ความกว้างการกระจายของเม็ดเลือดแดง หรือ RDW ซึ่งสะท้อนถึงระดับความผันแปรของขนาดเม็ดเลือด[118]

ค่าฮีโมโกลบิน ฮีมาโทคริตหรือจำนวนเม็ดเลือดแดงต่ำกว่าปกติบ่งชี้ภาวะเลือดจาง[119] ภาวะเลือดจางไม่ใช่การวินิจฉัยโรคในตัวเอง แต่เป็นการชี้ให้เห็นภาวะพื้นเดิมอย่างใดอย่างหนึ่งที่ส่งผลต่อเม็ดเลือดแดงของบุคคลนั้น[88] สาเหตุทั่วไปของภาวะเลือดจาง ได้แก่ การเสียเลือด การผลิตเม็ดเลือดแดงที่บกพร่อง (หรือการสร้างเม็ดเลือดแดงที่ไม่มีประสิทธิภาพ) การสร้างเม็ดเลือดแดงลดลง (การสร้างเม็ดเลือดแดงไม่เพียงพอ) และการเพิ่มการทำลายเม็ดเลือดแดง (ภาวะเลือดจางจากการสลายของเม็ดเลือดแดง)[120] ภาวะเลือดจางทำให้เลือดสามารถลำเลียงออกซิเจนได้ลดลง ทำให้เกิดอาการอย่างอ่อนเพลียและหายใจเร็ว[121] ถ้าระดับฮีโมโกลบินต่ำกว่าค่า ๆ หนึ่งซึ่งไม่เท่ากันขึ้นกับภาวะทางคลินิกของบุคคล อาจจำเป็นต้องรับการรักษาด้วยการถ่ายเลือด[122]
การเพิ่มจำนวนเม็ดเลือดแดงซึ่งโดยปกติทำให้มีฮีโมโกลบินและฮีมาโทคริตเพิ่มขึ้นตาม[note 4] เรียกว่า เม็ดเลือดแดงมาก[126] การขาดน้ำ หรือการใช้ยาขับปัสสาวะ อาจทำให้เกิดภาวะเม็ดเลือดแดงมาก "โดยสัมพัทธ์" ได้จากการลดสัดส่วนพลาสมาต่อเม็ดเลือดแดง การเพิ่มจำนวนเม็ดเลือดแดงอย่างแท้จริง ที่เรียก ภาวะเม็ดเลือดแดงมากสัมบูรณ์นั้น เกิดได้จากที่ร่างกายผลิตเม็ดเลือดแดงมากขึ้นเพื่อชดเชยระดับออกซิเจนต่ำเรื้อรังในสภาวะ เช่น โรคปอดหรือโรคหัวใจ หรือเมื่อคนมีระดับฮอร์โมนอีรีโทรโปอีติน (erythropoietin, EPO) สูงผิดปกติ ซึ่งเป็นฮอร์โมนที่กระตุ้นการสร้างเม็ดเลือดแดง ในภาวะโพลีไซทีเมีย เวอรา ไขกระดูกสร้างเม็ดเลือดแดงและเม็ดเลือดอื่น ๆ ในอัตราสูงเกิน[127]
การประเมินดัชนีเม็ดเลือดแดงมีประโยชน์ในการหาสาเหตุของภาวะเลือดจาง ถ้า MCV ต่ำจะเรียกว่า ภาวะเลือดจางเม็ดเลือดแดงเล็ก (microcytic) ส่วนภาวะเลือดจางที่มี MCV สูง เรียก ภาวะเลือดจางเม็ดเลือดแดงใหญ่ (marcocytic) ภาวะเลือดจางที่มี MCHC ต่ำเรียก ภาวะเลือดจางเม็ดเลือดแดงสีซีด (hypochromic) ถ้ามีภาวะเลือดจางแต่ดัชนีเม็ดเลือดแดงปกติ ภาวะเลือดจางนั้นเรียก ชนิดสีปกติ (normochromic) และขนาดปกติ (normocytic)[117] ทั้งนี้ โดยทั่วไปไม่ค่อยใช้คำว่า hyperchromia หมายถึง ภาวะที่ MCHC สูง ภาวะที่ทำให้ MCHC สูงกว่าค่าอ้างอิงขอบเขตบนนั้นพบน้อย ซึ่งส่วนใหญ่พบในภาวะ เช่น โรคเม็ดเลือดแดงทรงกลม (spherocytosis) โรคเม็ดเลือดแดงรูปเคียวและฮีโมโกลบินซี[115][128] ภาวะ MCHC สูงเท็จอาจเป็นผลจากการเกาะกลุ่มของเม็ดเลือดแดง (ซึ่งทำให้จำนวนเม็ดเลือดแดงลดลงเท็จ ซึ่งทำให้ MCHC สูงขึ้น)[129][130] หรือมีปริมาณลิพิดในเลือดสูง (ซึ่งทำให้ค่าฮีโมโกลบินสูงเท็จ)[128][131]
ภาวะเลือดจางเม็ดเลือดแดงเล็กตรงแบบสัมพันธ์กับการขาดธาตุเหล็ก ทาลัสซีเมีย ภาวะเลือดจางโรคเรื้อรัง ส่วนภาวะเลือดจางเม็ดเลือดแดงใหญ่สัมพันธ์กับโรคพิษสุรา การขาดโฟเลตและวิตามินบี12 การใช้ยาบางชนิด และโรคไขกระดูกบางชนิด สำหรับการเสียเลือด ภาวะเลือดจางจากการสลายของเม็ดเลือดแดง โรคไขกระดูก และโรคเรื้อรังหลายชนิดทำให้เกิดภาวะเลือดจางที่มีเม็ดเลือดขนาดปกติ[115][132] MCV ยังมีจุดประสงค์อีกอย่างหนึ่งในการควบคุมคุณภาพห้องปฏิบัติการ เพราะเป็นค่าที่ค่อนข้างคงที่ไม่เปลี่ยนแปลงตามเวลาเมื่อเทียบกับพารามิเตอร์อื่น ๆ ของ CBC ฉะนั้นการเปลี่ยนแปลงค่า MCV อย่างมากอาจบ่งบอกว่าตัวอย่างนั้นมาจากผู้ป่วยคนละคนกัน[133]
ค่า RDW ต่ำไม่มีความสำคัญทางคลินิก แต่เมื่อ RDW สูงขึ้นแสดงว่าเม็ดเลือดแดงมีขนาดแปรปรวนมากขึ้น เป็นภาวะที่เรียก ภาวะเม็ดเลือดแดงหลากขนาด (anisocytosis)[118] ภาวะเม็ดเลือดแดงหลากขนาดพบบ่อยในภาวะเลือดจางที่มีสาเหตุจากโภชนาการ เช่น เลือดจางจากการขาดธาตุเหล็ก และภาวะเลือดจางจากการขาดโฟเลตและวิตามินบี12 ส่วนผู้ป่วยทาลัสซีเมียอาจมี RDW ปกติได้[118] เมื่อได้ผลลัพธ์ CBC แล้ว อาจใช้การตรวจเพิ่มเติมเพื่อหาสาเหตุของภาวะเลือดจางต่อไป เช่น การทดสอบเฟอร์ริตินเพื่อยืนยันการขาดธาตุเหล็ก หรือฮีโมโกลบินอิเล็กโทรโฟเรซิส (hemoglobin electrophoresis) เพื่อวินิจฉัยความผิดปกติของฮีโมโกลบิน เช่น ทาลัสซีเมียหรือโรคเม็ดเลือดแดงรูปเคียว[134]
เม็ดเลือดขาว
[แก้]
|
|
เม็ดเลือดขาวทำหน้าที่ป้องกันการติดเชื้อ และมีส่วนในการตอบสนองต่อการอักเสบ[136] ภาวะที่มีเม็ดเลือดขาวสูงขึ้น (leukocytosis) มักพบในโรคติดเชื้อ การอักเสบ และภาวะความเครียดทางสรีรวิทยา นอกจากนี้ยังพบในโรคที่เกี่ยวข้องกับการผลิตเม็ดเลือด เช่น โรค myeloproliferative และ lymphoproliferative[137] ภาวะที่เม็ดเลือดขาวที่ลดลง (leukopenia) อาจทำให้บุคคลมีความเสี่ยงต่อการติดเชื้อสูงขึ้น[138] และพบในการรักษาบางอย่างเช่น เคมีบำบัดและรังสีบำบัด และภาวะต่าง ๆ ที่ยับยั้งการสร้างเม็ดเลือด[139] ภาวะพิษเหตุติดเชื้ออาจพบทั้งภาวะเม็ดเลือดขาวสูงและต่ำ[140] โดยปกติการรายงานจำนวนเม็ดเลือดขาวทั้งหมดใช้หน่วยเซลล์ต่อไมโครลิตรของเลือด (/μL) หรือ 109 เซลล์ต่อลิตร (× 109/L)[4]
ในการนับแยกชนิดเม็ดเลือดขาว จะรายงานประเภทและจำนวนเม็ดเลือดขาวชนิดต่าง ๆ การรายงานผลใช้หน่วยร้อยละและจำนวนสัมบูรณ์ต่อหน่วยปริมาตร ตรงแบบจะมีการวัดเซลล์เม็ดเลือดขาวห้าชนิด ได้แก่ นิวโทรฟิล ลิมโฟไซต์ โมโนไซต์ อีโอซิโนฟิล และเบโซฟิล[141] เครื่องมือบางชนิดรายงานจำนวนแกรนูโลไซต์ที่ไม่เจริญเต็มวัย ซึ่งเป็นการจำแนกประเภทที่ประกอบด้วยเซลล์ตั้งต้นของนิวโทรฟิล โดยเฉพาะโปรไมอีโลไซต์ ไมอีโลไซต์และเมทาไมอีโลไซต์[note 5][144] ส่วนเม็ดเลือดชนิดอื่น ๆ จะรายงานด้วยถ้าตรวจพบในการนับแยกชนิดด้วยมือ[145]
ผลการนับแยกชนิดมีประโยชน์ในการวินิจฉัยและเฝ้าติดตามภาวะทางการแพทย์หลายอย่าง ตัวอย่างเช่น ภาวะนิวโทรฟิลสูง (neutrophilia) สัมพันธ์กับการติดเชื้อแบคทีเรีย การอักเสบและโรค myeloproliferative[146][147] ในขณะที่นิวโตรฟิลในเลือดต่ำ (neutropenia) อาจเกิดในผู้ที่อยู่ระหว่างได้รับเคมีบำบัดหรือรับประทานยาบางชนิดหรือผู้ป่วยโรคที่มีผลต่อไขกระดูก[148][149] ภาวะนิวโตรฟิลในเลือดต่ำยังอาจเกิดจากความผิดปกติแต่กำเนิด และอาจเกิดขึ้นชั่วคราวหลังการติดเชื้อไวรัสหรือแบคทีเรียในเด็ก[150] ผู้ที่มีภาวะนิวโตรฟิลในเลือดต่ำรุนแรงและมีอาการทางคลินิกของการติดเชื้อจะได้รับการรักษาด้วยยาปฏิชีวนะเพื่อป้องกันโรคที่อาจเป็นอันตรายถึงชีวิต[151]

การเพิ่มจำนวนของนิวโทรฟิลแบบมีแถบ (band neutrophil) คือ นิวโทรฟิลอายุน้อยที่ขาดนิวเคลียสที่แยกออกเป็นส่วน ๆ (segmented nuclei) หรือแกรนูโลไซต์ที่ไม่เต็มวัย จะเรียกว่า การเลื่อนไปทางซ้าย (left shift) และพบในภาวะพิษเหตุติดเชื้อและความผิดปกติของเลือดบางอย่าง แต่ปกติในการตั้งครรภ์[152][153] ภาวะที่ลิมโฟไซต์สูงขึ้น (lymphocytosis) สัมพันธ์กับการติดเชื้อไวรัส[6] และโรค lymphoproliferative เช่น มะเร็งเม็ดเลือดขาวลิมโฟไซต์แบบเรื้อรัง[154] ภาวะที่โมโนไซต์สูงขึ้น (monocytosis) สัมพันธ์กับภาวะการอักเสบเรื้อรัง[155] และเม็ดเลือดขาวอีโอซิโนฟิลมักเพิ่มขึ้น (eosinophilia) ในการติดเชื้อปรสิตและภาวะภูมิแพ้[156] ภาวะที่เบโซฟิลสูง (basophilia) อาจพบในโรค myeloproliferative เช่น มะเร็งเม็ดเลือดขาวชนิดไมอิลอยด์เรื้อรัง และโพลีไซทีเมีย เวอรา[147] การพบเซลล์ผิดปกติบางชนิด เช่น เซลล์ตัวอ่อน หรือลิมโฟไซต์ที่มีลักษณะอย่างเนื้องอก บ่งบอกถึงโรคมะเร็งโลหิตวิทยา [89][157]
เกล็ดเลือด
[แก้]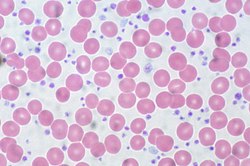
เกล็ดเลือดมีบทบาทสำคัญในการจับลิ่มของเลือด เมื่อผนังหลอดเลือดเสียหาย เกล็ดเลือดจะยึดเกาะกับผิวสัมผัสบริเวณที่ได้รับบาดเจ็บและอุดช่องว่าง การกระตุ้นในเวลาเดียวกันซึ่งลำดับการจับลิ่มของเลือด (coagulation cascade) ทำให้เกิดการก่อไฟบริน (fibrin) ซึ่งเสริมความแข็งแรงของก้อนเกล็ดเลือดเพื่อสร้างลิ่มเลือดที่เสถียร[158] ภาวะเกล็ดเลือดต่ำ (thrombocytopenia) อย่างรุนแรงอาจทำให้เลือดออกได้[159] ซึ่งอาจพบในผู้ที่อยู่ระหว่างการรักษาที่ยับยั้งไขกระดูก เช่น เคมีบำบัดหรือรังสีบำบัด หรือการรับประทานยาบางชนิด เช่น เฮปาริน ซึ่งเป็นตัวกระตุ้นระบบภูมิคุ้มกันให้ทำลายเกล็ดเลือด ภาวะเกล็ดเลือดต่ำเป็นลักษณะของโรคเลือดหลายชนิด เช่น มะเร็งเม็ดเลือดขาวเฉียบพลันและ ภาวะเลือดจางไม่สร้าง (aplastic anemia) ตลอดจนโรคภูมิต้านตนเองบางชนิด[160][161] หากจำนวนเกล็ดเลือดต่ำมาก อาจต้องรักษาด้วยการถ่ายเกล็ดเลือด[162] ภาวะเกล็ดเลือดมาก (thrombocytosis) อาจพบในภาวะการอักเสบหรือการบาดเจ็บ[163] เช่นเดียวกับการขาดธาตุเหล็ก[164] และจำนวนเกล็ดเลือดอาจสูงได้เป็นพิเศษในผู้มีภาวะเกล็ดเลือดต่ำปฐมภูมิ ซึ่งเป็นโรคเลือดหายากชนิดหนึ่ง การรายงานจำนวนเกล็ดเลือดใช้หน่วยเซลล์ต่อไมโครลิตรของเลือด (/μL), [165] 103 เซลล์ต่อไมโครลิตร (×103/μL) หรือ 109 เซลล์ต่อลิตร (× 109/L)[4]
ปริมาตรเกล็ดเลือดเฉลี่ย (MPV) เป็นการวัดขนาดเฉลี่ยของเกล็ดเลือดในหน่วยเฟมโตลิตร ซึ่งช่วยบอกสาเหตุของภาวะเกล็ดเลือดต่ำได้ MPV สูงอาจพบเมื่อเกล็ดเลือดตัวอ่อนถูกปล่อยเข้าสู่กระแสเลือดเพื่อชดเชยการทำลายเกล็ดเลือดที่เพิ่มขึ้น ขณะที่ภาวะการผลิตเกล็ดเลือดลดลงเนื่องจากโรคของไขกระดูกอาจส่งผลให้ค่า MPV ต่ำ; MPV ยังมีประโยชน์ช่วยแยกโรคแต่กำเนิดที่ทำให้เกิดภาวะเกล็ดเลือดต่ำ[118][166] นักวิเคราะห์บางคนรายงานเศษเกล็ดเลือดที่ไม่เต็มวัย (immature platelet fraction, IPF) หรือจำนวนเกล็ดเลือดลายตาข่าย (reticulated platelet) และให้สารนิเทศเกี่ยวกับอัตราการสร้างเกล็ดเลือดโดยการวัดจำนวนเกล็ดเลือดที่ยังไม่เต็มวัยในเลือด[167]
การทดสอบอื่น ๆ
[แก้]จำนวนเรติคูโลไซต์
[แก้]
เรติคูโลไซต์ (reticulocyte) เป็นเม็ดเลือดแดงที่ยังไม่เต็มวัยซึ่งยังมีอาร์เอ็นเอ ต่างจากเม็ดเลือดเต็มวัย การนับเรติคูโลไซต์บางทีเป็นส่วนหนึ่งของการตรวจ CBC ซึ่งโดยปกติเพื่อหาสาเหตุของภาวะเลือดจางของบุคคลหรือประเมินการตอบสนองต่อการรักษา ภาวะเลือดจางที่มีจำนวนเรติคูโลไซต์สูงสามารถบอกได้ว่าไขกระดูกกำลังผลิตเม็ดเลือดแดงในอัตราสูงขึ้นเพื่อชดเชยการเสียเลือดหรือการสลายของเม็ดเลือดแดง [74] ในขณะที่โรคโลหิตจางที่มีจำนวนเรติคูโลไซต์ต่ำอาจบ่งชี้ว่าบุคคลนั้นมีภาวะที่ลด ความสามารถของร่างกายในการผลิตเม็ดเลือดแดง [168] เมื่อผู้มีภาวะเลือดจางโภชนาการได้รับการเสริมอาหาร การเพิ่มจำนวนเรติคูโลไซต์บ่งชี้ว่าร่างกายตอบสนองต่อการรักษาโดยการผลิตเม็ดเลือดแดงมากขึ้น[169] เครื่องวิเคราะห์โลหิตวิทยาตรวจนับเรติคูโลไซต์โดยการย้อมเม็ดเลือดแดงด้วยสีย้อมที่จับกับ RNA และวัดจำนวนเรติคูโลไซต์ผ่านการกระเจิงของแสงหรือการวิเคราะห์การเรืองแสง การทดสอบสามารถทำได้ด้วยมือโดยการย้อมสีเลือดด้วยเมทิลีนบลูใหม่ และนับร้อยละของเม็ดเลือดแดงที่มี RNA ภายใต้กล้องจุลทรรศน์ จำนวนเรติคูโลไซต์แสดงเป็นจำนวนสัมบูรณ์[168] หรือเป็นร้อยละของเม็ดเลือดแดง [170]
เครื่องมือบางอย่างวัดปริมาณฮีโมโกลบินโดยเฉลี่ยในเรติคูโลไซต์แต่ละตัว ซึ่งเป็นพารามิเตอร์ที่มีการศึกษาว่าเป็นตัวบ่งชี้การขาดธาตุเหล็กในผู้ที่มีภาวะที่รบกวนการทดสอบมาตรฐาน[171] เศษส่วนเรติคูโลไซต์ที่ยังไม่เจริญเต็มวัย (immature reticulocyte fraction, IRF) เป็นการวัดอีกอย่างหนึ่งที่เครื่องวิเคราะห์บางชนิดรายงาน ซึ่งจะวัดปริมาณการเจริญเต็มวัยของเรติคูโลไซต์: เซลล์ที่เจริญเต็มวัยน้อยจะมี RNA มากกว่าและทำให้เกิดสัญญาณวาวแสงที่เข้มกว่า สารนิเทศนี้อาจเป็นประโยชน์ในการวินิจฉัยภาวะเลือดจาง และประเมินการสร้างเม็ดเลือดแดงหลังการรักษาภาวะเลือดจางหรือการปลูกถ่ายไขกระดูก[172]
เม็ดเลือดแดงมีนิวเคลียส
[แก้]ในระหว่างการสร้างเม็ดเลือดแดงในไขกระดูก ตับ และม้ามของทารกในครรภ์ [173] เม็ดเลือดแดงจะยังมีนิวเคลียส ซึ่งปกติไม่มีอยู่ในเม็ดเลือดที่เจริญเต็มวัยซึ่งไหลเวียนในกระแสเลือด[174] เมื่อพบว่ามีเม็ดเลือดแดงมีนิวเคลียส โดยเฉพาะในเด็กและผู้ใหญ่ บ่งชี้ว่าร่างกายมีความต้องการเม็ดเลือดแดงเพิ่มขึ้นซึ่งอาจเกิดจากเลือดออก มะเร็งบางชนิดและภาวะเลือดจาง[118] เครื่องวิเคราะห์ส่วนใหญ่สามารถตรวจจับเซลล์เหล่านี้ได้โดยรายงานเป็นส่วนหนึ่งของการนับแยกชนิดเม็ดเลือด ถ้ามีเม็ดเลือดแดงมีนิวเคลียสสูงอาจทำให้จำนวนเม็ดเลือดขาวสูงเทียมได้ ซึ่งต้องคำนวณปรับ[175]
พารามิเตอร์อื่น
[แก้]เครื่องวิเคราะห์โลหิตวิทยาขั้นสูงสามารถวัดเม็ดเลือดแบบใหม่ซึ่งได้แสดงให้เห็นถึงความสำคัญเชิงวินิจฉัยในการศึกษาวิจัย แต่ยังไม่พบว่ามีใช้ทางคลินิกอย่างแพร่หลาย[171] ตัวอย่างเช่นเครื่องวิเคราะห์บางประเภทอ่านค่าพิกัดระบุขนาดและตำแหน่งของคลัสเตอร์เม็ดเลือดขาว เรียก ข้อมูลประชากรเม็ดเลือด (cell population data)[176] มีการศึกษาพารามิเตอร์เหล่านี้ว่าอาจใช้เป็นสารส่อโรคเลือด การติดเชื้อแบคทีเรียและมาลาเรีย เครื่องวิเคราะห์ที่ใช้สีย้อมไมอีโลเพอร็อกซิเดสเพื่อใช้วัดการแสดงออกซึ่งเอ็นไซม์ของเม็ดเลือดขาว ซึ่งมีการแเปลี่ยแปลงในโรคต่าง ๆ[75] เครื่องมือบางอย่างสามารถรายงานร้อยละของเม็ดเลือดแดงที่มีสีซีดนอกเหนือไปจากรายงานค่า MCHC เฉลี่ย หรือบอกปริมาณเศษเม็ดเลือดแดง (schistocyte)[171] ซึ่งเกิดขึ้นในภาวะเลือดจางจากการสลายเม็ดเลือดแดงบางประเภท[177] เนื่องจากพารามิเตอร์เหล่านี้มักจะเฉพาะเจาะจงสำหรับเครื่องวิเคราะห์บางยี่ห้อ จึงเป็นการยากสำหรับห้องปฏิบัติการในการแปลและเปรียบเทียบผล[171]
พิสัยอ้างอิง
[แก้]| ทดสอบ | หน่วย | ผู้ใหญ่ | เด็ก
(อายุ 4–7 ปี) |
ทารกแรกเกิด
(0–1 วัน) |
|---|---|---|---|---|
| WBC | × 109/L | 3.6–10.6 | 5.0–17.0 | 9.0–37.0 |
| RBC | × 1012/L |
|
4.00–5.20 น | 4.10–6.10 |
| HGB | g/L |
|
102–152 | 165–215 |
| HCT | L/L |
|
0.36–0.46 | 0.48–0.68 |
| MCV | fL | 80–100 | 78–94 | 95–125 |
| MCH | pg | 26–34 | 23–31 | 30–42 |
| MCHC | g/L | 320–360 | 320–360 | 300–340 |
| RDW | % | 11.5–14.5 | 11.5–14.5 | สูง[note 6] |
| เกล็ดเลือด | × 109/L | 150–450 | 150–450 | 150–450 |
| นิวโทรฟิล | × 109/L | 1.7–7.5 | 1.5–11.0 | 3.7–30.0 |
| ลิมโฟไซต์ | × 109/L | 1.0–3.2 | 1.5–11.1 | 1.6–14.1 |
| โมโนไซต์ | × 109/L | 0.1–1.3 | 0.1–1.9 | 0.1–4.4 |
| อีโอซิโนฟิล | × 109/L | 0.0–0.3 | 0.0–0.7 | 0.0–1.5 |
| เบโซฟิล | × 109/L | 0.0–0.2 | 0.0–0.3 | 0.0–0.7 |
การแปลผลการนับเม็ดเลือดสมบูรณ์โดยการเปรียบเทียบผลกับพิสัยอ้างอิงซึ่งแสดงถึงผลลัพธ์ที่พบในผู้ที่ดูมีสุขภาพแข็งแรงร้อยละ 95[35] จากการแจกแจงปรกติทางสถิติ พิสัยของตัวอย่างที่ทดสอบจะแตกต่างกันตามเพศและอายุ โดยเฉลี่ยแล้วหญิงผู้ใหญ่มีฮีโมโกลบิน ฮีมาโทคริต และปริมาณเม็ดเลือดแดงน้อยกว่าชาย โดยช่วงต่างจะลดลงหลังวัยหมดประจำเดือน[179]
เลือดของทารกแรกเกิดต่างจากเด็กโตมาก จากที่เลือดเด็กโตก็แตกต่างจากผู้ใหญ่อยู่แล้ว ฮีโมโกลบิน ฮีมาโทคริตและปริมาณเม็ดเลือดแดงของทารกแรกเกิดมีค่าสูงมากเพื่อชดเชยกับระดับอ็อกซิเจนที่ต่ำในครรภ์ และมีสัดส่วนฮีโมโกลบินทารกในครรภ์สูง ซึ่งมีประสิทธิภาพลดลงในการส่งอ็อกซิเจนไปยังเนื้อเยื่อเมื่อเทียบกับฮีโมโกลบินของผู้ใหญ่[180][181] MCV ก็มีค่าเพิ่มขึ้น เช่นเดียวกับปริมาณเม็ดเลือดขาวโดยเน้นหนักไปที่นิวโทรฟิล[180][182] จำนวนเม็ดเลือดแดงและค่าที่เกี่ยวข้องเริ่มลดลงไม่นานหลังคลอด แตะจุดต่ำสุดเมื่ออายุประมาณ 2 เดือนและจะเพิ่มขึ้นหลังจากนั้น[183][184] เม็ดเลือดแดงของทารกและเด็กโตมีขนาดเล็ก โดยมี MCH ต่ำกว่าของผู้ใหญ่ ในการนับแยกชนิดเม็ดเลือดขาวในเด็ก ลิมโฟไซต์มักมีจำนวนมากกว่านิวโทรฟิล ขณะที่สัดส่วนนิวโทรฟิลในผู้ใหญ่มีมากกว่า[180]
ความแตกต่างอื่น ๆ ระหว่างประชากรอาจส่งผลต่อพิสัยอ้างอิง ตัวอย่างเช่นผู้ที่อาศัยอยู่ในที่สูงขึ้นจะมีผลของฮีโมโกลบิน ฮีมาโทคริตและ RBC สูงกว่า และผู้ที่บรรพบุรุษแอฟริกามีจำนวนเม็ดเลือดขาวโดยเฉลี่ยต่ำกว่า[185] ประเภทเครื่องวิเคราะห์ที่ใช้ทดสอบ CBC ก็มีผลต่อพิสัยอ้างอิงเช่นกัน ฉะนั้นพิสัยอ้างอิงกำหนดจากห้องปฏิบัติการเดี่ยว ๆ โดยอาศัยประชากรผู้ป่วยและเครื่องมือของตนเอง[186][187]
ข้อจำกัด
[แก้]ภาวะทางการแพทย์บางอย่างหรือปัญหาเกี่ยวกับตัวอย่างเลือดอาจให้ผลลัพธ์ที่ไม่แม่นยำ หากตัวอย่างมีลักษณะเป็นลิ่มเลือดอย่างเห็นได้ชัด ซึ่งอาจเกิดจากเทคนิคเจาะเลือดไม่ดี ตัวอย่างนั้นจะไม่เหมาะสมสำหรับการทดสอบ เพราะปริมาณเกล็ดเลือดจะต่ำเท็จ และผลลัพธ์อย่างอื่นอาจผิดปกติได้[188][189] ตัวอย่างที่เก็บ ณ อุณหภูมิห้องเป็นเวลาหลายชั่วโมงอาจให้ค่า MCV สูงเท็จ[190] เนื่องจากเม็ดเลือดแดงบวมเมื่อดูดน้ำจากพลาสมา และผลเกล็ดเลือดและการนับแยกชนิดเม็ดเลือดขาวอาจไม่แม่นยำในตัวอย่างที่มีอายุมาก เมื่อเม็ดเลือดเสื่อมสภาพตามเวลา[91]

ตัวอย่างที่เก็บจากบุคคลที่มีระดับบิลิรูบินหรือลิพิดสูงมากในพลาสมาก (icteric sample และ lipemic sample ตามลำดับ)[191] อาจแสดงค่าฮีโมโกลบินสูงผิดปกติได้เนื่องจากสสารเหล่านี้เปลี่ยนสีและภาวะทึบแสงของตัวอย่าง ซึ่งขัดขวางการวัดฮีโมโกลบิน[192] ผลดังกล่าวสามารถบรรเทาได้ด้วยการเปลี่ยนพลาสมาเป็นน้ำเกลือแทน[91]
บุคคลบางคนผลิตสารภูมิต้านทานที่ทำให้เกล็ดเลือดจับตัวเป็นก้อนเมื่อมีการดึงเลือดเข้าไปในท่อที่เคลือบสาร EDTA ซึ่งเป็นสารต้านการจับลิ่มของเลือดตรงแบบที่ใช้ในการเก็บตัวอย่าง CBC เครื่องวิเคราะห์อัตโนมัติอาจนับเป็นเกล็ดเลือดเดี่ยว อันจะทำให้ปริมาณเกล็ดเลือดต่ำเท็จได้ ภาวะนี้สามารถเลี่ยงได้โดยใช้สารต้านการจับลิ่มของเลือดอย่างอื่น เช่น โซเดียมซิเตรต หรือ เฮปาริน[193]
ภาวะที่สารภูมิต้านทานเป็นสื่อกลางอีกอย่างที่อาจกระทบต่อผลการนับเม็ดเลือดอย่างสมบูรณ์ คือ การเกาะกลุ่มของเม็ดเลือดแดง ปรากฏการณ์นี้ทำให้เม็ดเลือดแดงเกาะกลุ่มกันเนื่องจากสารภูมิต้านทานจับกับผิวเม็ดเลือด[194] เครื่องวิเคราะห์จะนับเม็ดเลือดแดงที่เกาะกลุ่มกันเป็นเม็ดเลือดเดียว ทำให้จำนวนเม็ดเลือดแดงและฮีมาโทคริตต่ำลงอย่างสังเกตได้ และ MCV และ MCHC สูงขึ้นอย่างเห็นได้ชัด[53] บ่อยครั้งสารภูมิต้านทานเหล่านี้จะมีฤทธิ์ที่อุณหภูมิห้องเท่านั้น (ซึ่งในกรณีนี้เรียกว่า แอกลูตินินเย็น) และการเกาะกลุ่มสามารถย้อนกลับได้โดยให้ความร้อนตัวอย่างที่อุณหภูมิ 37 องศาเซลเซียส อย่างไรก็ดี ตัวอย่างจากผู้ป่วยภาวะเลือดจางจากการสลายของเม็ดเลือดแดงชนิดภูมิต้านตัวเองแบบอุ่นอาจมีการเกาะกลุ่มของเม็ดเลือดแดงซึ่งแก้ไขไม่ได้ด้วยการอุ่นตัวอย่าง[130]
ในขณะที่เซลล์วัยอ่อนและมะเร็งปุ่มน้ำเหลืองสามารถระบุได้ในการนับแยกชนิดด้วยมือ แต่การตรวจด้วยกล้องจุลทรรศน์ไม่สามารถระบุสายการสร้างเม็ดเลือด (hematopoietic linage) ได้อย่างน่าเชื่อถือ เมื่อระบุเม็ดเลือดผิดปกติได้แล้ว จำเป็นต้องใช้การระบุฟีโนไทป์ภูมิคุ้มกัน (immunophenotyping) ด้วยวิธีโฟลไซโทเมตรี (flow cytometry) เพื่อระบุสารส่อที่ให้สารนิเทศเพิ่มเติมเกี่ยวกับเม็ดเลือดดังกล่าว[195][196]
ประวัติศาสตร์
[แก้]
ก่อนมีการใช้เครื่องนับเซลล์อัตโนมัติ การตรวจนับเม็ดเลือดอย่างสมบูรณ์ใช้วิธีมือ โดยนับเม็ดเลือดแดง เม็ดเลือดขาวและเกล็ดเลือดโดยใช้กล้องจุลทรรศน์[198] บุคคลแรกที่จัดพิมพ์ผลการสังเกตเม็ดเลือดด้วยกล้องจุลทรรศน์ คือ อันโตนี ฟัน เลเวินฮุก[199] ซึ่งรายงานลักษณะปรากฏของเม็ดเลือดแดงในจดหมาย ค.ศ. 1674 ถึง จดหมายเหตุการประชุมราชสมาคมแห่งลอนดอน [200] Jan Swammerdam อธิบายเม็ดเลือดแดงเมื่อหลายปีก่อน แต่ไม่ได้จัดพิมพ์ผลการค้นพบของเขาในเวลานั้น ตลอดคริสต์ศตวรรษที่ 18 และ 19 การปรับปรุงเทคโนโลยีกล้องจุลทรรศน์ เช่น เลนส์ไม่มีสี ทำให้สามารถนับเม็ดเลือดขาวและเกล็ดเลือดในตัวอย่างที่ไม่ย้อมสีได้[201]
Karl Vierordt นักสรีรวิทยา ได้รับความชอบว่าเป็นผู้นับเม็ดเลือดครั้งแรก[8][202][203] เทคนิคของเขาซึ่งจัดพิมพ์ใน ค.ศ. 1852 เกี่ยวข้องกับการดูดเลือดปริมาตรที่วัดอย่างระมัดระวังลงในหลอดฝอย และเกลี่ยลงบนสไลด์กล้องจุลทรรศน์ที่เคลือบด้วยไข่ขาว หลังจากเลือดแห้งแล้ว เขานับเซลล์ทุกเซลล์บนสไลด์ กระบวนการนี้อาจใช้เวลานานกว่าสามชั่วโมงจึงเสร็จ[204] เครื่องวัดเม็ดเลือดแดงซึ่งเริ่มใช้ใน ค.ศ. 1874 โดย Louis-Charles Malassez ทำให้การนับเม็ดเลือดด้วยกล้องจุลทรรศน์ง่ายขึ้น[205] ฮีโมไซโตมิเตอร์ (hemocytometer) ของ Malassez ประกอบด้วยสไลด์กล้องจุลทรรศน์ที่มีหลอดฝอยแบน เลือดเจือจางถูกใส่ในห้องฝอยโดยติดท่อยางไว้ปลายหนึ่ง และไปยังห้องเส้นเลือดฝอยโดยใช้ท่อยางที่ติดอยู่ที่ปลายด้านหนึ่งและมีการติดเลนส์ตาที่มีตาตารางมาตราส่วนกับกล้องจุลทรรศน์ ทำให้ผู้ใหล้กล้องนับจำนวนเม็ดเลือดต่อปริมาตรเลือด ใน ค.ศ. 1877 William Gowers ประดิษฐ์ฮีโมไซโตมิเตอร์ที่มีตาตารางใช้นับในตัวทำให้ไม่จำเป็นต้องผลิตเลนส์ตาที่ต้องปรับพิกัดเฉพาะสำหรับกล้องจุลทรรศน์แต่ละตัว[206]

ในคริสต์ทศวรรษ 1870 Paul Ehrlich พัฒนาเทคนิคการย้อมสีโดยใช้สีย้อมกรดและเบสผสมกันซึ่งสามารถแยกแยะเม็ดเลือดขาวชนิดต่าง ๆ และช่วยให้ตรวจสอบสัณฐานวิทยาของเม็ดเลือดแดงได้[201] Dmitri Leonidovich Romanowsky ปรับปรุงเทคนิคนี้ในคริสต์ทศวรรษ 1890 โดยใช้ส่วนผสมของอีโอซินและเมทิลีนบลูมีอายุเพื่อสร้างสีสันหลากหลายซึ่งไม่มีอยู่ถ้าใช้สีย้อมโดด สิ่งนี้กลายเป็นพื้นฐานสำหรับการย้อมสี Romanowsky เทคนิคนี้ยังใช้กันอยู่เพื่อย้อมสีฟิล์มเลือดสำหรับการทบทวนด้วยมือ[207]
เทคนิคแรกในการวัดฮีโมโกลบินคิดค้นขึ้นในช่วงปลายคริสต์ศตวรรษที่ 19 และเกี่ยวข้องกับการเปรียบเทียบสีของเลือดเจือจางด้วยตากับมาตรฐานที่ทราบ[203] ความพยายามที่จะทำให้กระบวนการเป็นอัตโนมัติโดยใช้วิธีสเปกโตรโฟโตเมตรี (spectrophotometry) และการวัดสี (colorimetry) ถูกจำกัดโดยข้อเท็จจริงว่าฮีโมโกลบินในเลือดนั้นมีหลายแบบ หมายความว่าฮีโมโกลบินเหล่านี้ไม่สามารถวัดได้ที่ความยาวคลื่นค่าเดียว ต่อมาใน ค.ศ. 1920 มีการนำวิธีการแปลงรูปฮีโมโกลบินต่าง ๆ ไปเป็นแบบเสถียรแบบเดียว (ไซแอนเมทฮีโมโกลบินหรือเฮมิโกลบินไซยาไนด์) มาใช้ ทำให้สามารถวัดระดับฮีโมโกลบินได้อย่างอัตโนมัติ วิธีไซแอนเมทฮีโมโกลบินยังคงเป็นวิธีอ้างอิงสำหรับการวัดค่าฮีโมโกลบินและยังคงใช้กันอยู่ในเครื่องวิเคราะห์โลหิตวิทยาแบบอัตโนมัติจำนวนมาก[57][208][209]
Maxwell Wintrobe ได้รับความชอบจากการคิดค้นการทดสอบฮีมาโทคริต[66][210] ใน ค.ศ. 1929 เขาเข้าร่วมโครงการปริญญาเอกที่มหาวิทยาลัยทูเลน เพื่อกำหนดพิสัยปกติสำหรับพารามิเตอร์ของเม็ดเลือดแดงและคิดค้นวิธีการที่เรียก Wintrobe hematocrit ทั้งนี้ การวัดฮีมาโทคริตมีอธิบายไว้ก่อนหน้านี้แล้วในวรรณกรรม แต่วิธีการของ Wintrobe มีข้อแตกต่างตรงที่ใช้ท่อขนาดใหญ่ที่สามารถผลิตได้จำนวนมากตามข้อกำหนดที่แม่นยำโดยมีมาตราส่วนผลิตในตัว วัดส่วนของเม็ดเลือดแดงในหลอดถูกวัดหลังการหมุนเหวี่ยงเพื่อหาค่าฮีมาโทคริต การประดิษฐ์วิธีการวัดค่าฮีมาโทคริตที่ทำซ้ำได้ทำให้ Wintrobe นิยามดัชนีเม็ดเลือดแดงได้[203]

เริ่มมีการวิจัยเกี่ยวกับการนับเม็ดเลือดอัตโนมัติในต้นคริสต์ศตวรรษที่ 20[209] วิธีการที่พัฒนาขึ้นใน ค.ศ. 1928 ใช้ปริมาณแสงที่ส่งผ่านตัวอย่างเลือดเจือจางซึ่งวัดโดยวิธีวัดแสง เพื่อกะประมาณจำนวนเม็ดเลือดแดง แต่พิสูจน์แล้วว่าวิธีนี้ไม่ถูกต้องแม่นยำสำหรับตัวอย่างที่มีเม็ดเลือดแดงผิดปกติ[8] ความพยายามอื่น ๆ ที่ไม่ประสบความสำเร็จในคริสต์ทศวรรษ 1930 และ 1940 นั้นเกี่ยวข้องกับเครื่องตรวจจับไฟฟ้าและแสง (photoelectric) ที่ติดอยู่กับกล้องจุลทรรศน์ ซึ่งจะนับเม็ดเลือดเมื่อส่องกราด ปลายคริสต์ทศวรรษ 1940 Wallace H. Coulter ได้รับแรงบันดาลใจจากความจำเป็นต้องมีวิธีการนับเม็ดเลือดแดงที่ดีขึ้นให้หลังการทิ้งระเบิดนิวเคลียร์ที่ฮิโรชิมาและนางาซากิ[211] พยายามปรับปรุงเทคนิคการนับเม็ดเลือดด้วยไฟฟ้าและแสง งานวิจัยของเขาได้รับความช่วยเหลือจากพี่ชาย Joseph R. Coulter ในห้องปฏิบัติการชั้นใต้ดินในชิคาโก[60] ผลลัพธ์ของพวกเขาซึ่งใช้วิธีไฟฟ้าและแสงนั้นน่าผิดหวัง และใน ค.ศ. 1948 หลังจากอ่านบทความที่เชื่อมโยงสภาพนำของเลือดกับความเข้มข้นของเม็ดเลือดแดง Wallace ได้คิดค้นหลักการโคลเตอร์ ซึ่งเป็นทฤษฎีว่าเม็ดเลือดที่แขวนลอยในตัวกลางนำจะมีกระแสลดลงได้สัดส่วนกับขนาดขณะที่ผ่านรู
ในเดือนตุลาคมปีนั้น วอลเลซได้สร้างแครื่องนับเพื่อสาธิตหลักการดังกล่าว เนื่องจากข้อจำกัดทางการเงิน จึงใช้วิธีเผาเป็นรูผ่านแผ่นเซลโลเฟนจากห่อบุหรี่[60][211] วอลเลซยื่นจดสิทธิบัตรสำหรับเทคนิคนี้ใน ค.ศ. 1949 และ ค.ศ. 1951 ได้ยื่นต่อสำนักงานการวิจัยนาวิกเพื่อขอเงินทุนสำหรับการพัฒนาเครื่องนับโคลเตอร์[211] คำขอสิทธิบัตรของ Wallace ได้รับอนุมัติใน ค.ศ. 1953 และหลังจากการปรับปรุงรูและเริ่มใช้มาตรความดันของไหลปรอทเพื่อให้ควบคุมขนาดตัวอย่างอย่างแม่นยำ สองพี่น้องก่อตั้ง Coulter Electronics Inc. ใน ค.ศ. 1958 เพื่อขายเรื่องมือของพวกตน เครื่องนับโคลเตอร์ออกแบบมาในทีแรกเพื่อการนับเม็ดเลือดแดง แต่มีการดัดแปลงในภายหลังทำให้พิสูจน์ว่ามีประสิทธิภาพในการนับเม็ดเลือดขาวด้วย เครื่องนับโคลเตอร์มีการนำมาใช้ในห้องปฏิบัติการทางการแพทย์อย่างแพร่หลาย[209]
เครื่องวิเคราะห์เครื่องแรกที่สามารถรายงานปริมาณเม็ดเลือดหลายชนิดได้พร้อมกัน คือ Technicon SMA 4A−7A ซึ่งวางจำหน่ายใน ค.ศ. 1965 เครื่องดังกล่าวใช้วิธีแบ่งตัวอย่างเลือดออกเป็นสองช่อง ช่องหนึ่งสำหรับนับเม็ดเลือดแดงและเม็ดเลือดขาว และอีกช่องหนึ่งสำหรับวัดฮีโมโกลบิน อย่างไรก็ดี เครื่องมือนี้ไม่น่าเชื่อถือและบำรุงรักษายาก ใน ค.ศ. 1968 เครื่องวิเคราะห์ Coulter Model S มีการวางจำหน่ายและมีการนำมาใช้อย่างแพร่หลาย เครื่องมือนี้มีห้องปฏิกิริยาสองห้องคล้ายกับเครื่อง Technicon ห้องหนึ่งใช้นับเม็ดเลือดแดง และอีกห้องหนึ่งใช้นับเม็ดเลือดขาวและวัดฮีโมโกลบิน Model S ยังใช้หาปริมาตรเฉลี่ยของเม็ดเลือดโดยใช้การวัดความต้านทานต่อการผ่าน (impedance) ซึ่งทำให้คำนวณหาดัชนีเม็ดเลือดแดงและฮีมาโทคริตได้ การตรวจนับเกล็ดเลือดอัตโนมัติเริ่มนำมาใช้ใน ค.ศ. 1970 ด้วยเครื่องมือ Hemalog-8 ของ Technicon และเครื่องวัดชุด Coulter's S Plus ใน ค.ศ. 1980[212]
หลังจากการนับเซลล์พื้นฐานเป็นแบบอัตโนมัติแล้ว การนับแยกชนิดเม็ดเลือดขาวยังคงเป็นความท้าทาย ตลอดคริสต์ทศวรรษ 1970 นักวิจัยสำรวจวิธีการนับแยกชนิดอัตโนมัติสองวิธี ได้แก่ การประมวลผลภาพดิจิทัลและโฟลไซโตเมทรี มีการผลิตแบบเครื่องประมวลผลภาพหลายแบบ โดยใช้เทคโนโลยีที่พัฒนาขึ้นในคริสต์ทศวรรษ 1950 และ 1960 เพื่อใช้อ่านการทดสอบแพปอัตโนมัติ[213] เครื่องมือเหล่านี้จะส่องกราดฟิล์มเลือดที่ย้อมสีแล้วเพื่อหานิวเคลียสของเซลล์ และถ่ายภาพสแน็ปช็อตของเม็ดเลือดเพื่อวิเคราะห์ด้วยวิธีการวัดความหนาแน่น (densitometry)[214] เครื่องเหล่านี้มีราคาแพง ช้า และไม่ได้ลดภาระงานของห้องปฏิบัติการมากนัก เพาะยังต้องเตรียมและย้อมสีฟิล์มเลือดอยู่ ดังนั้นระบบที่ใช้โฟลไซโทเมตรีจึงได้รับความนิยมมากกว่า[215][216] และจนถึง ค.ศ. 1990 ไม่มีเครื่องวิเคราะห์ภาพดิจิทัลที่มีขายพาณิชย์ในสหรัฐหรือยุโรปตะวันตก[217] เทคนิคเหล่านี้กลับฟื้นขึ้นมาในคริสต์ทศวรรษ 2000 เมื่อเริ่มใช้แพลตฟอร์มการวิเคราะห์ภาพขั้นก้าวหน้ามากขึ้นโดยใช้โครงข่ายประสาทเทียม[218][219][220]
อุปกรณ์โฟลไซโตเมตรีในช่วงแรกยิงลำแสงใส่เม็ดเลือดในช่วงความยาวคลื่นจำเพาะ และความดูดกลืนรังสี การเรืองแสงและการกระเจิงของแสงที่ได้ จากนั้นเก็บรวบรวมสารนิเทศเกี่ยวกับลักษณะของเม็ดเลือดและเปิดให้วัดสิ่งที่อยู่ในเม็ดเลือดอย่างดีเอ็นเอได้[221] เครื่องมือดังกล่าวอย่างหนึ่ง คือ Rapid Cell Spectrophotometer ซึ่งพัฒนาโดย Louis Kamentsky ใน ค.ศ. 1965 เพื่อทำให้ศึกษาวิทยาเซลล์ปากมดลูกได้อย่างอัตโนมัติ สามารถสร้างสแกตเตอร์แกรม (scattergram) ของเม็ดเลือดโดยใช้เทคนิคการย้อมสีสารเคมีภายในเซลล์ Leonard Ornstein ผู้ช่วยพัฒนาระบบการย้อมสีบน Rapid Cell Spectrophotometer และเพื่อนร่วมงานของเขา ต่อมาสร้างเครื่องวิเคราะห์การนับแยกชนิดเม็ดเลือดขาวแบบโฟลไซโทเมตรีพาณิชย์เครื่องแรกชื่อ Hemalog D.[222][223] เปิดตัวใน ค.ศ. 1974[224][225] เครื่องวิเคราะห์นี้ใช้การกระเจิงแสง ความดูดกลืนรังสีและการย้อมสีเซลล์เพื่อระบุชนิดของเม็ดเลือดขาวปกติ 5 ชนิดนอกเหนือจาก "เซลล์ระบุไม่ได้ขนาดใหญ่" ซึ่งเป็นกลุ่มจำแนกที่ปกติประกอบด้วยลิมโฟไซต์ชนิดไม่ตรงแบบและเซลล์วัยอ่อน Hemalog D สามารถนับเม็ดเลือด 10,000 เม็ดเลือดได้ในครั้งเดียว ซึ่งเป็นพัฒนาการอย่างมากจากการนับแยกชนิดด้วยมือ [226] ใน ค.ศ. 1981 Technicon รวมเครื่องวิเคราะห์ Hemalog D กับ Hemalog-8 เพื่อผลิต Technicon H6000 เครื่องวิเคราะห์นับเม็ดเลือดอย่างสมบูรณ์และนับแยกชนิดรวมเครื่องแรก เครื่องวิเคราะห์นี้ไม่ได้รับความนิยมในห้องปฏิบัติการโลหิตวิทยาเนื่องจากต้องใช้แรงงานมาก แต่ในปลายคริสต์ทศวรรษ 1980 และต้นคริสต์ทศวรรษ 1990 มีการผลิตระบบที่คล้ายกันอย่างกว้างขวางโดยผู้ผลิตรายอื่น เช่น Sysmex, Abbott, Roche และ Beckman Coulter[227]
อรรถาธิบาย
[แก้]- ↑ บางทีเกล็ดเลือดอาจมีคำเรียกในภาษาอังกฤษว่า cell แต่ที่จริงเกล็ดเลือดไม่ใช่เซลล์ แต่เป็นเศษเซลล์ที่เกิดจากไซโทพลาซึมของเมกาคารีโอไซต์ในไขกระดูก[6]
- ↑ ข้อมูลที่ใช้จัดทำพิสัยอ้างอิงปกติมาจากผู้รับการทดสอบ "ปกติ" แต่ก็มีความเป็นไปได้ว่าบุคคลเหล่านั้นอาจมีโรคที่ไม่แสดงอาการ[34]
- ↑ ในความหมายอย่างกว้างที่สุด คำว่า "โฟลไซโทเมตรี" หมายถึงการวัดคุณสมบัติของเซลล์เดี่ยวในกระแสของไหล[49][50] และในความหมายนี้ เครื่องวิเคราะห์โลหิตวิทยาทุกเครื่อง (ยกเว้นเครื่องที่ใช้วิธีประมวลผลภาพดิจิทัล) จึงเป็นโฟลไซโทมิเตอร์ อย่างไรก็ดี ความหมายของคำที่ใช้กันทั่วไปนั้นพาดพิงถึงวิธีการกระเจิงของแสงและฟลูออเรสเซนต์ โดยเฉพาะอย่างยิ่งเครื่องที่มีการระบุประเภทของเม็ดเลือดโดยใช้สารภูมิต้านทานติดป้ายซึ่งติดกับสารส่อบนผิวเซลล์ (การหาอิมมูโนฟีโนไทป์)[49][51]
- ↑ แต่ไม่เสมอไป ตัวอย่างเช่น ในทาลัสซีเมียบางประเภท พบภาวะจำนวนเม็ดเลือดแดงสูงแต่มีฮีโมโกลบินต่ำหรือปกติ เพราะเม็ดเลือดแดงมีขนาดเล็กมาก[123][124] ดัชนีเมนต์เซอร์ (Mentzer index) ซึ่งเปรียบเทียบ MCV กับจำนวน RBC สามารถใช้เพื่อแยกแยะระหว่างภาวะเลือดจางจากการขาดธาตุเหล็กกับทาลัสซีเมีย[125]
- ↑ เครื่องมืออัตโนมัติจัดกลุ่มเม็ดเลือดสามชนิดรวมกันในกลุ่ม "แกรนูโลไซต์ที่ยังไม่เจริญเต็มวัย"[142] แต่นับแยกกันด้วยวิธีมือ[143]
- ↑ RDW สูงมากเมื่อเกิด และจะค่อย ๆ ลดลงจนถึงอายุประมาณ 6 เดือน[178]
อ้างอิง
[แก้]แหล่งที่มา
[แก้]- ↑ Tefferi, A; Hanson, CA; Inwards, DJ (2005). "How to interpret and pursue an abnormal complete blood cell count in adults". Mayo Clinic Proceedings. 80 (7): 923–936. doi:10.4065/80.7.923. ISSN 0025-6196. PMID 16212155.
- 1 2 HealthDirect (August 2018). "Full blood count". HealthDirect.gov.au. เก็บจากแหล่งเดิมเมื่อ 2 April 2019. สืบค้นเมื่อ 8 September 2020.
- ↑ "Blood tests: Chronic lymphocytic leukaemia (CLL)". Cancer Research UK. 18 September 2020. เก็บจากแหล่งเดิมเมื่อ 23 October 2020. สืบค้นเมื่อ 23 October 2020.
- 1 2 3 4 5 6 American Association for Clinical Chemistry (12 August 2020). "Complete Blood Count (CBC)". Lab Tests Online. เก็บจากแหล่งเดิมเมื่อ 18 August 2020. สืบค้นเมื่อ 8 September 2020.
- 1 2 3 Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Advantages and sources of error with automated hematology".
- 1 2 Turgeon, ML (2016). p. 309.
- ↑ Harmening, DM (2009). pp. 2–3.
- 1 2 3 Green, R; Wachsmann-Hogiu, S (2015). "Development, history, and future of automated cell counters". Clinics in Laboratory Medicine. 35 (1): 1–10. doi:10.1016/j.cll.2014.11.003. ISSN 0272-2712. PMID 25676368.
- 1 2 Keohane, E et al. (2015). p. 244.
- ↑ Leach, M (2014). "Interpretation of the full blood count in systemic disease – a guide for the physician". The Journal of the Royal College of Physicians of Edinburgh. 44 (1): 36–41. doi:10.4997/JRCPE.2014.109. ISSN 1478-2715. PMID 24995446.
- ↑ Marshall, WJ et al. (2014). p. 497.
- 1 2 3 Van Leeuwen, AM; Bladh, ML (2019). p. 377.
- ↑ Lewandrowski, K et al. (2016). p. 96.
- ↑ American Association of Blood Banks (24 April 2014). "Five Things Physicians and Patients Should Question". Choosing Wisely: an initiative of the ABIM Foundation. American Association of Blood Banks. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 24 September 2014. สืบค้นเมื่อ 12 July 2020.
- 1 2 Lewandrowski, K et al. (2016). p. 97.
- ↑ Hartman, CJ; Kavoussi, LR (2017). pp. 4–5.
- ↑ Dewan, M (2016). "Reducing unnecessary postoperative complete blood count testing in the pediatric intensive care unit". The Permanente Journal. doi:10.7812/TPP/16-051. ISSN 1552-5767. PMC 5283785. PMID 28241909.
- ↑ Walls, R et al. (2017). p. 130.
- ↑ Walls, R et al. (2017). p. 219.
- ↑ Walls, R et al. (2017). p. 199.
- ↑ Walls, R et al. (2017). p. 1464.
- ↑ Moore, EE et al. (2017). p. 162.
- ↑ Lewis, SL et al. (2015). p. 280.
- ↑ Wiciński, M; Węclewicz, MM (2018). "Clozapine-induced agranulocytosis/granulocytopenia". Current Opinion in Hematology. 25 (1): 22–28. doi:10.1097/MOH.0000000000000391. ISSN 1065-6251. PMID 28984748.
- ↑ Fatemi, SH; Clayton, PJ. (2016). p. 666.
- ↑ Dooley, EK; Ringler, RL. (2012). pp. 20–21.
- ↑ Keohane, E et al. (2015). pp. 834–835.
- ↑ Schafermeyer, RW et al. (2018). pp. 467–468.
- ↑ Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Introduction".
- ↑ Kaushansky, K et al. (2015). p. 11.
- ↑ Kaushansky, K et al. (2015). p. 43.
- ↑ Kaushansky, K et al. (2015). pp. 42–44.
- ↑ McPherson, RA; Pincus, MR (2017). p. 574.
- ↑ Bain, BJ et al. (2017). p. 8.
- 1 2 Bain, BJ et al. (2017). p. 10.
- ↑ Bain, BJ (2015). p. 213.
- ↑ Keohane, E et al. (2015). p. 245.
- 1 2 Lewandrowski, K et al. (2016). pp. 96–97.
- ↑ "Routine Preoperative Tests for Elective Surgery (NG45)". National Institute for Health and Care Excellence. 5 April 2016. เก็บจากแหล่งเดิมเมื่อ 28 July 2020. สืบค้นเมื่อ 8 September 2020.
- ↑ Kirkham, KR et al. (2016). p. 805.
- ↑ Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Specimen collection".
- ↑ Keohane, E et al. (2015). p. 28.
- ↑ Bain, BJ et al. (2017). p. 1.
- ↑ Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Cell counts", "Volume of packed red cells (hematocrit)", "Leukocyte differentials".
- 1 2 3 4 Bain, BJ et al. (2017). pp. 551–555.
- ↑ Bain, BJ (2015). p. 29.
- ↑ Dasgupta, A; Sepulveda, JL (2013). p. 305.
- 1 2 D’Souza, C; Briggs, C; Machin, SJ (2015). "Platelets: the few, the young and the active". Clinics in Laboratory Medicine. 35 (1): 123–131. doi:10.1016/j.cll.2014.11.002. ISSN 0272-2712. PMID 25676376.
- 1 2 3 Kottke-Marchant, K; Davis, B (2012). p. 8.
- ↑ Shapiro, HM (2003). p. 1.
- ↑ Bakke, AC (2001). "The principles of flow cytometry". Laboratory Medicine. 32 (4): 207–211. doi:10.1309/2H43-5EC2-K22U-YC6T. ISSN 1943-7730.
- ↑ Kaushansky, K et al. (2015). p. 12.
- 1 2 Bain, BJ et al. (2017). pp. 32–33.
- ↑ McPherson, RA; Pincus, MR (2017). p. 44.
- ↑ Bain, BJ (2015). pp. 29–30.
- ↑ Whitehead, RD; Mei, Z; Mapango, C; Jefferds, MED (August 2019). "Methods and analyzers for hemoglobin measurement in clinical laboratories and field settings". Annals of the New York Academy of Sciences. 1450 (1): 147–171. doi:10.1111/nyas.14124. PMC 6709845. PMID 31162693.
- 1 2 Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Hemoglobin concentration".
- 1 2 Keohane, E et al. (2015). p. 208.
- ↑ Bain, BJ (2015). pp. 30–31.
- 1 2 3 Graham, MD (2003). "The Coulter principle: foundation of an industry". Journal of the Association for Laboratory Automation. 8 (6): 72–81. doi:10.1016/S1535-5535(03)00023-6. ISSN 1535-5535.
- ↑ Keohane, E et al. (2015). pp. 208–209.
- ↑ Bain, BJ et al. (2017). p. 32.
- ↑ Keohane, E et al. (2015). pp. 210–211.
- ↑ Keohane, E et al. (2015). p. 210.
- ↑ Kottke-Marchant, K; Davis, B (2012). p. 27.
- 1 2 3 4 5 Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Volume of packed red cells (hematocrit)".
- ↑ Smock, KJ. Chapter 1 in Greer JP et al, ed. (2018), sec. "Mean corpuscular volume"; "Mean corpuscular hemoglobin"; "Mean corpuscular hemoglobin concentration"; "Red cell distribution width".
- ↑ Keohane, E et al. (2015). p. 2.
- ↑ Keohane, E et al. (2015). p. 209.
- 1 2 3 Bain, BJ et al. (2017). p. 37.
- ↑ Arneth, BM; Menschikowki, M. (2015). p. 3.
- 1 2 3 Smock, KJ. Chapter 1 in Greer JP et al, ed. (2018), sec. "Leukocyte differentials".
- ↑ Naeim, F et al. (2009). p. 210.
- 1 2 Turgeon, ML (2016). p. 318.
- 1 2 Bain, BJ et al. (2017). p. 39.
- 1 2 Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Introduction"; "Cell counts".
- 1 2 3 4 Gulati, G; Song, J; Dulau Florea, A; Gong, J (2013). "Purpose and criteria for blood smear scan, blood smear examination, and blood smear review". Annals of Laboratory Medicine. 33 (1): 1–7. doi:10.3343/alm.2013.33.1.1. ISSN 2234-3806. PMC 3535191. PMID 23301216.
- 1 2 Mooney, C; Byrne, M; Kapuya, P; Pentony, L; De la Salle, B; Cambridge, T; Foley, D (2019). "Point of care testing in general haematology". British Journal of Haematology. 187 (3): 296–306. doi:10.1111/bjh.16208. ISSN 0007-1048. PMID 31578729.
- 1 2 Sireci, AN (2015). "Hematology testing in urgent care and resource-poor settings: an overview of point of care and satellite testing". Clinics in Laboratory Medicine. 35 (1): 197–207. doi:10.1016/j.cll.2014.10.009. ISSN 0272-2712. PMID 25676380.
- ↑ Bain, BJ et al. (2017). p. 43.
- ↑ Keohane, E et al. (2015). p. 225.
- ↑ Bain, BJ. (2015). pp. 9–11.
- ↑ Palmer, L et al. (2015). pp. 288–289.
- ↑ Turgeon, ML (2016). pp. 325–326.
- ↑ Bain, BJ (2015). p. 98.
- ↑ Bain, BJ (2015). p. 154.
- ↑ Wang, SA; Hasserjian, RP (2018). p. 10.
- 1 2 Turgeon, ML (2016). p. 329.
- 1 2 d'Onofrio, G; Zini, G. (2014). p. 289.
- ↑ Palmer, L et al. (2015). pp. 296–297.
- 1 2 3 Keohane, E et al. (2015). p. 226.
- 1 2 Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Cell counts".
- ↑ Keohane, E et al. (2017) p. 189.
- ↑ Bain, BJ (2015). pp. 22–23.
- ↑ Keohane, E et al. (2017). pp. 190–191.
- ↑ Bain, BJ et al. (2017). pp. 19–22.
- ↑ Bain, BJ et al. (2017). pp. 548–552.
- ↑ Keohane, E et al. (2015). p. 46.
- 1 2 3 Vis, JY; Huisman, A (2016). "Verification and quality control of routine hematology analyzers". International Journal of Laboratory Hematology. 38: 100–109. doi:10.1111/ijlh.12503. ISSN 1751-5521. PMID 27161194.
- 1 2 Kottke-Marchant, K; Davis, B (2012). pp. 697–698.
- ↑ Pai, S; Frater, JL (2019). "Quality management and accreditation in laboratory hematology: Perspectives from India". International Journal of Laboratory Hematology. 41 (S1): 177–183. doi:10.1111/ijlh.13017. ISSN 1751-5521. PMID 31069974.
- ↑ Greer, JP (2008). p. 4.
- ↑ Kottke-Marchant, K; Davis, B (2012). p. 438.
- ↑ Bain, BJ et al. (2017). pp. 539–540.
- ↑ Favaloro, EJ; Jennings, I; Olson, J; Van Cott, EM; Bonar, R; Gosselin, R; Meijer, P (2018). "Towards harmonization of external quality assessment/proficiency testing in hemostasis". Clinical Chemistry and Laboratory Medicine (CCLM). 0 (0). doi:10.1515/cclm-2018-0077. ISSN 1437-4331. PMID 29668440.
- ↑ Bain, BJ et al. (2017). p. 551.
- ↑ Keohane, E et al. (2015). pp. 4–5.
- ↑ Blann, A; Ahmed, N (2014). p. 106.
- ↑ Turgeon, ML (2016). p. 293.
- ↑ Bain, BJ et al. (2017). pp. 33–34.
- ↑ Turgeon, ML (2016). pp. 319–320.
- ↑ Brereton, M; McCafferty, R; Marsden, K; Kawai, Y; Etzell, J; Ermens, A (2016). "Recommendation for standardization of haematology reporting units used in the extended blood count". International Journal of Laboratory Hematology. 38 (5): 472–482. doi:10.1111/ijlh.12563. ISSN 1751-5521. PMID 27565952.
- ↑ Keohane, E et al. (2015). p. 195.
- 1 2 Bain, BJ (2015). p. 22.
- 1 2 3 4 Keohane, E et al. (2015). p. 196.
- ↑ Schmaier, AH; Lazarus, HM (2012). p. 25.
- 1 2 Bain, BJ (2015). pp. 73–75.
- 1 2 3 4 5 May, JE; Marques, MB; Reddy, VVB; Gangaraju, R (2019). "Three neglected numbers in the CBC: The RDW, MPV, and NRBC count". Cleveland Clinic Journal of Medicine. 86 (3): 167–172. doi:10.3949/ccjm.86a.18072. ISSN 0891-1150. PMID 30849034.
- ↑ Keohane, E et al. (2015). p. 285.
- ↑ Keohane, E et al. (2015). p. 286.
- ↑ Kaushansky, K et al. (2015). p. 503.
- ↑ Vieth, JT; Lane, DR (2014). pp. 11-12.
- ↑ Bain, BJ (2015). p. 297.
- ↑ DiGregorio, RV et al. (2014). pp. 491–493.
- ↑ Isaacs, C et al. (2017). p. 331.
- ↑ Bain, BJ (2015). p. 232.
- ↑ McPherson, RA; Pincus, MR (2017). pp. 600–601.
- 1 2 Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Mean corpuscular hemoglobin concentration".
- ↑ Keohane, E et al. (2015). p. 197.
- 1 2 Kottke-Marchant, K; Davis, B (2012). p. 88.
- ↑ Bain, BJ (2015). p. 193.
- ↑ Bain, BJ et al. (2017). pp. 501–502.
- ↑ Ciesla, B (2018). p. 26.
- ↑ Powell, DJ; Achebe, MO. (2016). pp. 530, 537–539.
- ↑ Harmening, DM (2009). p. 380.
- ↑ Pagana, TJ et al. (2014). p. 992.
- ↑ Walls, R et al. (2017). pp. 1480–1481.
- ↑ Territo, M (January 2020). "Overview of White Blood Cell Disorders". Merck Manuals Consumer Version. เก็บจากแหล่งเดิมเมื่อ 23 June 2020. สืบค้นเมื่อ 8 September 2020.
- ↑ Pagana, TJ et al. (2014). p. 991.
- ↑ McCulloh, RJ; Opal, SM.
- ↑ American Association for Clinical Chemistry (29 July 2020). "WBC Differential". Lab Tests Online. เก็บจากแหล่งเดิมเมื่อ 19 August 2020. สืบค้นเมื่อ 8 September 2020.
- ↑ Wang, SA; Hasserjian, RP (2018). p. 8.
- ↑ Palmer, L et al. (2015). pp. 294–295.
- ↑ Chabot-Richards, DS; George, TI (2015). p. 10.
- ↑ Palmer, L et al. (2015). p. 294.
- ↑ Turgeon, ML (2016). p. 306.
- 1 2 Kaushansky, K et al. (2015). p. 44.
- ↑ Hoffman, EJ et al. (2013). p. 644.
- ↑ Porwit, A et al. (2011). pp. 247–252.
- ↑ Walls, R et al. (2017). p. 1483.
- ↑ Walls, R et al. (2017). pp. 1497–1498.
- ↑ Bain, BJ (2015). p. 99.
- ↑ Bain, BJ et al. (2017). p. 85.
- ↑ Bain, BJ et al. (2017). p. 498.
- ↑ Bain, BJ (2015). p. 243.
- ↑ Porwit, A et al. (2011). p. 256.
- ↑ Palmer, L et al. (2015). p. 298.
- ↑ Turgeon, ML (2016). pp. 358–360.
- ↑ Kaushansky, K et al. (2015). p. 1993.
- ↑ Turgeon, ML (2016). p. 315.
- ↑ Walls, R et al. (2017). pp. 1486–1488.
- ↑ Kaufman, RM; Djulbegovic, B; Gernsheimer, T; Kleinman, S; Tinmouth, A T.; Capocelli, KE; และคณะ (2015). "Platelet transfusion: a clinical practice guideline from the AABB". Annals of Internal Medicine. 162 (3): 205. doi:10.7326/M14-1589. ISSN 0003-4819. PMID 25383671.
- ↑ Keohane, E et al. (2015). p. 4.
- ↑ Walls, R et al. (2017). p. 1489.
- ↑ Gersten, T (25 August 2020). "Platelet count: MedlinePlus Medical Encyclopedia". MedlinePlus. United States National Library of Medicine. เก็บจากแหล่งเดิมเมื่อ 9 September 2020. สืบค้นเมื่อ 9 September 2020.
- ↑ Wang, SA; Hasserjian, RP (2018). p. 7.
- ↑ Kaushansky, K et al. (2015). pp. 18–19.
- 1 2 Kaushansky, K et al. (2015). p. 14.
- ↑ Turgeon, ML (2016). pp. 318–319.
- ↑ Turgeon, ML (2016). p. 319.
- 1 2 3 4 Kaushansky, K et al. (2015). p. 16.
- ↑ Bain, BJ et al. (2017). pp. 42–43.
- ↑ Harmening, DM (2009). pp. 8–10.
- ↑ Constantino, B; Cogionis, B (2000). "Nucleated RBCs – significance in the peripheral blood film". Laboratory Medicine. doi:10.1309/D70F-HCC1-XX1T-4ETE.
- ↑ Zandecki, M et al. (2007). pp. 24–25.
- ↑ Virk, H; Varma, N; Naseem, S; Bihana, I; Sukhachev, D (2019). "Utility of cell population data (VCS parameters) as a rapid screening tool for acute myeloid leukemia (AML) in resource-constrained laboratories". Journal of Clinical Laboratory Analysis. 33 (2): e22679. doi:10.1002/jcla.22679. ISSN 0887-8013. PMID 30267430.
- ↑ Bain, BJ (2015). p. 90.
- 1 2 Keohane, E et al. (2015).
- ↑ Bain, BJ (2015). pp. 211–213.
- 1 2 3 Bain, BJ (2015). p. 143.
- ↑ Lanzkowsky, P et al. (2016). p. 197.
- ↑ Kaushansky, K et al. (2015). p. 99.
- ↑ Kaushansky, K et al. (2015). p. 103.
- ↑ Bain, BJ (2015). p. 220.
- ↑ Bain, BJ (2015). p. 214.
- ↑ Bain, BJ et al. (2017). pp. 8–10.
- ↑ Palmer, L et al. (2015). p. 296.
- ↑ Bain, BJ (2015). p. 195.
- ↑ Kottke-Marchant, K; Davis, B (2012). p. 67.
- ↑ Bain, BJ (2015). p. 194.
- ↑ Turgeon, ML (2016). p. 91.
- ↑ Kottke-Marchant, K; Davis, B (2012) pp. 80, 86–87.
- ↑ Bain, BJ (2015). pp. 196–197.
- ↑ Rodak, BF; Carr, JH. (2013). p. 109.
- ↑ Wang, SA; Hasserjian, RP (2018). p. 9.
- ↑ Kottke-Marchant, K; Davis, B (2012). pp. 19–20.
- ↑ Science Museum, London. "Haemoglobinometer, United Kingdom, 1850–1950". Wellcome Collection. เก็บจากแหล่งเดิมเมื่อ 29 March 2020. สืบค้นเมื่อ 29 March 2020.
- ↑ Keohane, E et al. (2015). pp. 1–4.
- ↑ Kottke-Marchant, K; Davis, B. (2012). p. 1.
- ↑ Wintrobe, MM. (1985). p. 10.
- 1 2 Kottke-Marchant, K; Davis, B. (2012). pp. 3–4.
- ↑ Verso, ML (May 1962). "The evolution of blood counting techniques". Read at a Meeting of the Section of the History of Medicine, First Australian Medical Congress. 8 (2): 149–158. doi:10.1017/s0025727300029392. PMC 1033366. PMID 14139094.
- 1 2 3 Means, RT (2011). "It all started in New Orleans: Wintrobe, the hematocrit and the definition of normal". The American Journal of the Medical Sciences. 341 (1): 64–65. doi:10.1097/MAJ.0b013e3181e2eb09. ISSN 0002-9629. PMID 21191263. อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่สมเหตุสมผล มีนิยามชื่อ "Means2011" หลายครั้งด้วยเนื้อหาต่างกัน - ↑ Davis, JD (1995). p. 167.
- ↑ Kottke-Marchant, K; Davis, B (2012). p. 4.
- ↑ Davis, JD (1995). pp. 168–171.
- ↑ Bezrukov, AV (2017). "Romanowsky staining, the Romanowsky effect and thoughts on the question of scientific priority". Biotechnic & Histochemistry. 92 (1): 29–35. doi:10.1080/10520295.2016.1250285. ISSN 1052-0295. PMID 28098484.
- ↑ Keohane, E et al. (2015). p. 134.
- 1 2 3 Kottke-Marchant, K; Davis, B (2012). p. 5.
- ↑ Robinson, JP (2013). "Wallace H. Coulter: decades of invention and discovery". Cytometry Part A. 83A (5): 424–438. doi:10.1002/cyto.a.22296. ISSN 1552-4922. PMID 23596093.
- 1 2 3 Graham, MD (2013). "The Coulter principle: Imaginary origins". Cytometry Part A. 83 (12): 1057–1061. doi:10.1002/cyto.a.22398. ISSN 1552-4922. PMC 4237176. PMID 24151220.
- ↑ Kottke-Marchant, K; Davis, B (2012). p. 6.
- ↑ Groner, W (1995). pp. 12–14.
- ↑ Lewis, SM (1981). "Automated differential leucocyte counting: Present status and future trends". Blut. 43 (1): 1–6. doi:10.1007/BF00319925. ISSN 0006-5242. PMID 7260399.
- ↑ Da Costa, L (2015). p. 5.
- ↑ Groner, W (1995). pp. 12–15.
- ↑ Bentley, SA (1990). "Automated differential white cell counts: a critical appraisal". Baillière's Clinical Haematology. 3 (4): 851–869. doi:10.1016/S0950-3536(05)80138-6. ISSN 0950-3536. PMID 2271793.
- ↑ Kratz, A; Lee, S; Zini, G; Riedl, JA; Hur, M; Machin, S (2019). "Digital morphology analyzers in hematology: ICSH review and recommendations". International Journal of Laboratory Hematology. doi:10.1111/ijlh.13042. ISSN 1751-5521. PMID 31046197.
- ↑ Da Costa, L (2015). pp. 5–6.
- ↑ McCann, SR (2016). p. 193.
- ↑ Melamed, M (2001). pp. 5–6.
- ↑ Shapiro, HM (2003). pp. 84–85.
- ↑ Melamed, M. (2001). p. 8.
- ↑ Picot, J et al. (2012). p. 110.
- ↑ Mansberg, HP; Saunders, AM; Groner, W (1974). "The Hemalog D white cell differential system". Journal of Histochemistry & Cytochemistry. 22 (7): 711–724. doi:10.1177/22.7.711. ISSN 0022-1554. PMID 4137312.
- ↑ Pierre, RV (2002). p. 281.
- ↑ Kottke-Marchant, K; Davis, B (2012). pp. 8–9.
บรรณานุกรม
[แก้]- Arneth, BM; Menschikowki, M (2015). "Technology and new fluorescence flow cytometry parameters in hematological analyzers". Journal of Clinical Laboratory Analysis. 29 (3): 175–183. doi:10.1002/jcla.21747. ISSN 0887-8013. PMC 6807107. PMID 24797912.
- Bain, BJ (2015). Blood Cells: A Practical Guide (5 ed.). John Wiley & Sons. ISBN 978-1-118-81733-9.
- Bain, BJ; Bates, I; Laffan, MA (2017). Dacie and Lewis Practical Haematology (12 ed.). Elsevier Health Sciences. ISBN 978-0-7020-6925-3.
- Blann, A; Ahmed, N (2014). Blood Science (1 ed.). Institute of Biomedical Science. p. 106. ISBN 978-1-118-35146-8.
- Chabot-Richards, DS; George, TI (2015). "White blood cell counts". Clinics in Laboratory Medicine. 35 (1): 11–24. doi:10.1016/j.cll.2014.10.007. ISSN 0272-2712. PMID 25676369.
- Ciesla, B (2018). Hematology in Practice (3 ed.). F. A. Davis Company. ISBN 978-0-8036-6825-6.
- Da Costa, L (2015). "Digital image analysis of blood cells". Clinics in Laboratory Medicine. 35 (1): 105–122. doi:10.1016/j.cll.2014.10.005. ISSN 0272-2712. PMID 25676375.
- Dasgupta, A; Sepulveda, JL (2013). Accurate Results in the Clinical Laboratory: A Guide to Error Detection and Correction. Elsevier. ISBN 978-0-12-415858-0.
- Davis, JD (1995). "The evolution of the progressive-era hemocytometer". Caduceus: A Humanities Journal for Medicine and the Health Sciences. 11 (3): 164–183. PMID 8680947.
- DiGregorio, RV; Green-Hernandez, C; Holzemer, SP (2014). Primary Care: An Interprofessional Perspective (2 ed.). Springer Publishing Company. ISBN 978-0-8261-7148-1.
- Dooley, EK; Ringler, RL (2012). "Prenatal care: touching the future". Primary Care: Clinics in Office Practice. 39 (1): 17–37. doi:10.1016/j.pop.2011.11.002. ISSN 0095-4543. PMID 22309579.
- Fatemi, SH; Clayton, PJ (2016). The Medical Basis of Psychiatry (4 ed.). Springer. ISBN 978-1-4939-2528-5.
- Greer, JP (2008). Wintrobe's Clinical Hematology (12 ed.). Lippincott Williams & Wilkins. ISBN 978-0-7817-6507-7.
- Greer, JP; Arber, DA; Glader, BE; List, AF; Means, RM; Rodgers, GM (2018). Wintrobe's Clinical Hematology (14 ed.). Wolters Kluwer Health. ISBN 978-1-4963-6713-6.
- Groner, W (1995). Practical Guide to Modern Hematology Analyzers. Wiley. ISBN 978-0-471-95712-6.
- Harmening, D (2009). Clinical Hematology and Fundamentals of Hemostasis (5 ed.). F. A. Davis Company. ISBN 978-0-8036-1732-2.
- Hartman, CJ; Kavoussi, LR (2017). Handbook of Surgical Technique: A True Surgeon's Guide to Navigating the Operating Room. Elsevier Health Sciences. ISBN 978-0-323-51222-0.
- Hoffman, R; Benz, Jr., EJ; Silberstein, LE; Heslop, H; Anastasi, J; Weitz, J (2013). Hematology: Basic Principles and Practice (6 ed.). Elsevier Health Sciences. ISBN 978-1-4377-2928-3.
- Isaacs, C; Agarwala, S; Cheson, B (2017). Hoffman and Abeloff's Hematology-Oncology Review (1 ed.). Elsevier Health Sciences. ISBN 978-0-323-44318-0.
- Kaushansky, K; Lichtman, MA; Prchal, J; Levi, MM; Press, OW; Burns, LJ; Caligiuri, M (2015). Williams Hematology (9 ed.). McGraw-Hill Education. ISBN 978-0-07-183301-1.
- Keohane, E; Smith, L; Walenga, J (2015). Rodak's Hematology: Clinical Principles and Applications (5 ed.). Elsevier Health Sciences. ISBN 978-0-323-23906-6.
- Kirkham, KR; Wijeysundera, DN; Pendrith, C; Ng, R; Tu, JV; Boozary, AS; และคณะ (2016). "Preoperative laboratory investigations". Anesthesiology. 124 (4): 804–814. doi:10.1097/ALN.0000000000001013. ISSN 0003-3022. PMID 26825151. S2CID 35916964.
- Kottke-Marchant, K; Davis, B (2012). Laboratory Hematology Practice (1 ed.). John Wiley & Sons. ISBN 978-1-4443-9857-1.
- Lanzkowsky, P; Lipton, JM; Fish, JD (2016). Lanzkowsky's Manual of Pediatric Hematology and Oncology. Elsevier Science. ISBN 978-0-12-801674-9.
- Lewandrowski, K; Rudolf, J (2016). "Utilization Management in the Routine Hematology Laboratory". ใน Lewandrowski J, Sluss PM (บ.ก.). Utilization Management in the Clinical Laboratory and Other Ancillary Services. Springer. doi:10.1007/978-3-319-34199-6_10. ISBN 978-3-319-34199-6.
- Lewis, SL; Dirksen, SR; Heitkempet, MM; Bucher, L; Camera, I (2015). Medical-Surgical Nursing: Assessment and Management of Clinical Problems, Single Volume (8 ed.). Elsevier Health Sciences. ISBN 978-0-323-29033-3.
- Marshall, WJ; Lapsley, M; Day, A; Ayling, R (2014). Clinical Biochemistry E-Book: Metabolic and Clinical Aspects (3 ed.). Elsevier Health Sciences. ISBN 978-0-7020-5478-5.
- McCann, SR (2016). A History of Haematology: From Herodotus to HIV. OUP Oxford. ISBN 978-0-19-102713-0.
- McPherson, RA; Pincus, MR (2017). Henry's Clinical Diagnosis and Management by Laboratory Methods (23 ed.). Elsevier Health Sciences. ISBN 978-0-323-41315-2.
- Melamed, M (2001). "Chapter 1 a brief history of flow cytometry and sorting". Methods in Cell Biology. Vol. 63 part A. Elsevier. pp. 3–17. doi:10.1016/S0091-679X(01)63005-X. ISBN 978-0-12-544166-7. PMID 11060834.
- Moore, EE; Feliciano, DV; Mattox, KL (2017). Trauma (8 ed.). McGraw-Hill Education. ISBN 978-1-260-12860-4.
- Naeim, F; Rao, PN; Grody, WW (2009). Hematopathology: Morphology, Immunophenotype, Cytogenetics, and Molecular Approaches (1 ed.). Academic Press. ISBN 978-0-08-091948-5.
- d'Onofrio, G; Zini, G (2014). Morphology of Blood Disorders (2 ed.). Wiley. ISBN 978-1-118-44258-6.
- Oropello, JM; Kvetan, V; Pastores, SM (2016). Lange Critical Care. McGraw-Hill Education. ISBN 978-0-07-181726-4.
- Pagana, KD; Pagana, TJ; Pagana, TN (2014). Mosby's Diagnostic and Laboratory Test Reference. Elsevier Health Sciences. ISBN 978-0-323-22592-2.
- Palmer, L; Briggs, C; McFadden, S; Zini, G; Burthem, J; Rozenberg, G; Proytcheva, M; Machin, SJ (2015). "ICSH recommendations for the standardization of nomenclature and grading of peripheral blood cell morphological features". International Journal of Laboratory Hematology. 37 (3): 287–303. doi:10.1111/ijlh.12327. ISSN 1751-5521. PMID 25728865.
- Picot, J; Guerin, CL; Le Van Kim, C; Boulanger, C (2012). "Flow cytometry: retrospective, fundamentals and recent instrumentation". Cytotechnology. 64 (2): 109–130. doi:10.1007/s10616-011-9415-0. ISSN 0920-9069. PMC 3279584. PMID 22271369.
- Porwit, A; McCullough, J; Erber, WN (2011). Blood and Bone Marrow Pathology (2 ed.). Elsevier Health Sciences. ISBN 978-0-7020-4535-6.
- Pierre, RV (2002). "Peripheral blood film review: the demise of the eyecount leukocyte differential". Clinics in Laboratory Medicine. 22 (1): 279–297. doi:10.1016/S0272-2712(03)00075-1. ISSN 0272-2712. PMID 11933579.
- Powell, DJ; Achebe, MO (2016). "Anemia for the primary care physician". Primary Care: Clinics in Office Practice. 43 (4): 527–542. doi:10.1016/j.pop.2016.07.006. ISSN 0095-4543. PMID 27866575.
- Rodak, BF; Carr, JH (2013). Clinical Hematology Atlas (4 ed.). Elsevier Health Sciences. ISBN 978-1-4557-0830-7.
- Schafermeyer, RW; Tenenbein, M; Macias, CJ (2018). Strange and Schafermeyer's Pediatric Emergency Medicine (5 ed.). McGraw-Hill Education. ISBN 978-1-259-86076-8.
- Shapiro, HM (2003). Practical Flow Cytometry (4 ed.). John Wiley & Sons. ISBN 978-0-471-43403-0.
- Schmaier, AH; Lazarus, HM (2012). Concise guide to hematology (1 ed.). Wiley-Blackwell. ISBN 978-1-4051-9666-6.
- Turgeon, ML (2016). Linné & Ringsrud's Clinical Laboratory Science: Concepts, Procedures, and Clinical Applications (7 ed.). Elsevier Mosby. ISBN 978-0-323-22545-8.
- Van Leeuwen, AM; Bladh, ML (2019). Davis's Comprehensive Manual of Laboratory and Diagnostic Tests with Nursing Implications (8 ed.). F. A. Davis Company. ISBN 978-0-8036-9448-4.
- Vieth, JT; Lane, DR (2014). "Anemia". Emergency Medicine Clinics of North America. 32 (3): 613–628. doi:10.1016/j.emc.2014.04.007. ISSN 0733-8627. PMID 25060253.
- Walls, R; Hockberger, R; Gausche-Hill, M (2017). Rosen's Emergency Medicine - Concepts and Clinical Practice (9 ed.). Elsevier Health Sciences. ISBN 978-0-323-39016-3.
- Wang, SA; Hasserjian, RP (2018). Diagnosis of Blood and Bone Marrow Disorders. Springer. ISBN 978-3-319-20279-2.
- Wintrobe, MM (1985). Hematology, the Blossoming of a Science: A Story of Inspiration and Effort. Lea & Febiger. ISBN 978-0-8121-0961-0.
- Zandecki, M; Genevieve, F; Gerard, J; Godon, A (February 2007). "Spurious counts and spurious results on haematology analysers: a review. Part II: white blood cells, red blood cells, haemoglobin, red cell indices and reticulocytes". International Journal of Laboratory Hematology. 29 (1): 21–41. doi:10.1111/j.1365-2257.2006.00871.x. PMID 17224005.


