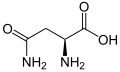
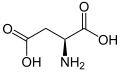
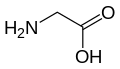
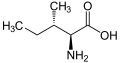
Протеїногенна амінокислота

Протеїногенні амінокислоти — це амінокислоти, які біосинтетично включаються до білків під час трансляції з РНК. Слово «протеїногенні» означає «створюючи білок». У відомому нам житті існує 22 генетично кодовані (протеїногенні) амінокислоти, 20 з яких входять до стандартного генетичного коду, а ще 2 (селеноцистеїн і піролізин) можуть бути включені за допомогою спеціальних механізмів трансляції.[1]
На відміну від них, непротеїногенні амінокислоти — це амінокислоти, які або не включаються до складу білків (як ГАМК, L-ДОФА або трийодтиронін), неправильно включаються замість генетично кодованої амінокислоти, або не виробляються безпосередньо та ізольовано стандартними клітинними механізмами (як гідроксипролін). Останнє часто є результатом посттрансляційної модифікації білків. Деякі непротеїногенні амінокислоти включаються до складу нерибосомних пептидів, які синтезуються нерибосомними пептидсинтетазами.
Як еукаріоти, так і прокаріоти до складу своїх білків можуть включати селеноцистеїн за допомогою нуклеотидної послідовності, відомої як SECIS-елемент, яка спрямовує клітину на трансляцію сусіднього кодону UGA як селеноцистеїну (UGA зазвичай є стоп-кодоном). У деяких метаногенних прокаріотів кодон UAG (зазвичай стоп-кодон) також може бути трансльований у піролізин.[2]
У еукаріотів існує лише 21 протеїногенна амінокислота, 20 стандартного генетичного коду, плюс селеноцистеїн. З інших амінокислот або з інших молекул проміжного метаболізму людський організм може синтезувати 12 амінокислот. Інші дев'ять повинні споживатися (зазвичай у вигляді їх білкових похідних), тому їх називають незамінними амінокислотами. Незамінними амінокислотами є гістидин, ізолейцин, лейцин, лізин, метіонін, фенілаланін, треонін, триптофан і валін (тобто H, I, L, K, M, F, T, W, V).[3]
Було виявлено, що протеїногенні амінокислоти пов'язані з набором амінокислот, які можуть розпізнаватися системами аутоаміноацилювання рибозимів.[4] Таким чином, непротеїногенні амінокислоти були виключені через випадковий еволюційний процес нуклеотидних форм життя. Були запропоновані й інші причини, щоб пояснити, чому певні специфічні непротеїногенні амінокислоти зазвичай не включаються до складу білків; наприклад, орнітин і гомосерин циклізуються відносно пептидного остова та фрагментують білок з відносно коротким періодом напіврозпаду, тоді як інші є токсичними, оскільки їх можна помилково включити до складу білків, як-от аналог аргініну канаванін.
Було висловлено припущення, що еволюційний відбір певних протеїногенних амінокислот з первинного бульйону, на відміну від непротеїногенних амінокислот, зумовлений їх кращим включенням у поліпептидний ланцюг.[5]
Нижче наведено структури та абревіатури 21 амінокислоти, які безпосередньо кодуються для синтезу білка генетичним кодом еукаріотів. Наведені нижче структури є стандартними хімічними структурами, а не типовими формами цвітер-іонів, що існують у водних розчинах.

IUPAC/IUBMB тепер також рекомендує стандартні скорочення для наступних двох амінокислот:
-
L -селеноцистеїн
(Sec / U) -
L -піролізин
(Pyl/ О)
Нижче наведено таблицю, в якій перераховано однолітерні символи, трилітерні символи та хімічні властивості бічних ланцюгів стандартних амінокислот. Зазначені маси базуються на середньозважених значеннях елементарних ізотопів за їх природного вмісту. Утворення пептидного зв'язку призводить до відщеплення молекули води. Отже, маса білка дорівнює масі амінокислот, з яких складається білок, мінус 18,01524 Да на пептидний зв'язок.
| Амінокислота | Однолітерне позначення | Абревіатура | Середня маса (Да) | Ізоелектрична точка | pK1 (α-COO−) |
pK2 (α-NH3+) |
|---|---|---|---|---|---|---|
| Alanine | A | Ala | 89.09404 | 6.01 | 2.35 | 9.87 |
| Cysteine | C | Cys | 121.15404 | 5.05 | 1.92 | 10.70 |
| Aspartic acid | D | Asp | 133.10384 | 2.85 | 1.99 | 9.90 |
| Glutamic acid | E | Glu | 147.13074 | 3.15 | 2.10 | 9.47 |
| Phenylalanine | F | Phe | 165.19184 | 5.49 | 2.20 | 9.31 |
| Glycine | G | Gly | 75.06714 | 6.06 | 2.35 | 9.78 |
| Histidine | H | His | 155.15634 | 7.60 | 1.80 | 9.33 |
| Isoleucine | I | Ile | 131.17464 | 6.05 | 2.32 | 9.76 |
| Lysine | K | Lys | 146.18934 | 9.60 | 2.16 | 9.06 |
| Leucine | L | Leu | 131.17464 | 6.01 | 2.33 | 9.74 |
| Methionine | M | Met | 149.20784 | 5.74 | 2.13 | 9.28 |
| Asparagine | N | Asn | 132.11904 | 5.41 | 2.14 | 8.72 |
| Pyrrolysine | O | Pyl | 255.31 | ? | ? | ? |
| Proline | P | Pro | 115.13194 | 6.30 | 1.95 | 10.64 |
| Glutamine | Q | Gln | 146.14594 | 5.65 | 2.17 | 9.13 |
| Arginine | R | Arg | 174.20274 | 10.76 | 1.82 | 8.99 |
| Serine | S | Ser | 105.09344 | 5.68 | 2.19 | 9.21 |
| Threonine | T | Thr | 119.12034 | 5.60 | 2.09 | 9.10 |
| Selenocysteine | U | Sec | 168.053 | 5.47 | 1.91 | 10 |
| Valine | V | Val | 117.14784 | 6.00 | 2.39 | 9.74 |
| Tryptophan | W | Trp | 204.22844 | 5.89 | 2.46 | 9.41 |
| Tyrosine | Y | Tyr | 181.19124 | 5.64 | 2.20 | 9.21 |
| Амінокислота | Боковий ланцюг | Гідрофобність | pKa§ | Полярність | pH | Малий розмір | Слабкість | Ароматичнаабо аліфатична | Радіус Ван дер Ваалься(Å3) |
|---|---|---|---|---|---|---|---|---|---|
| Alanine | -CH3 | - | - | Аліфатична | 67 | ||||
| Cysteine | -CH2SH | 8.55 | кисла | - | 86 | ||||
| Aspartic acid | -CH2COOH | 3.67 | кисла | - | 91 | ||||
| Glutamic acid | -CH2CH2COOH | 4.25 | кисла | - | 109 | ||||
| Phenylalanine | -CH2C6H5 | - | - | Ароматична | 135 | ||||
| Glycine | -H | - | - | - | 48 | ||||
| Histidine | -CH2-C3H3N2 | 6.54 | слабо основна | Ароматична | 118 | ||||
| Isoleucine | -CH(CH3)CH2CH3 | - | - | Аліфатична | 124 | ||||
| Lysine | -(CH2)4NH2 | 10.40 | основна | - | 135 | ||||
| Leucine | -CH2CH(CH3)2 | - | - | Аліфатична | 124 | ||||
| Methionine | -CH2CH2SCH3 | - | - | Аліфатична | 124 | ||||
| Asparagine | -CH2CONH2 | - | - | - | 96 | ||||
| Pyrrolysine | -(CH2)4NHCOC4H5NCH3 | N.D. | слабо основна | - | ? | ||||
| Proline | -CH2CH2CH2- | - | - | - | 90 | ||||
| Glutamine | -CH2CH2CONH2 | - | - | - | 114 | ||||
| Arginine | -(CH2)3NH-C(NH)NH2 | 12.3 | сильно основна | - | 148 | ||||
| Serine | -CH2OH | - | - | - | 73 | ||||
| Threonine | -CH(OH)CH3 | - | - | - | 93 | ||||
| Selenocysteine | -CH2SeH | 5.43 | кисла | - | ? | ||||
| Valine | -CH(CH3)2 | - | - | Аліфатична | 105 | ||||
| Tryptophan | -CH2C8H6N | - | - | Ароматична | 163 | ||||
| Tyrosine | -CH2-C6H4OH | 9.84 | слабо кисла | Ароматична | 141 |
§: Тільки іонізуючі залишки мають значуще значення pKa. Значення для Asp, Cys, Glu, His, Lys та Tyr були визначені з використанням амінокислотного залишку, розташованого центрально в аланіновому пентапептиді.[6] Значення для Arg взято з Pace et al. (2009).[7] Значення для Sec взято з Byun & Kang (2011).[8]
| Амінокислота | Кодон(и) | Частота у білках | Незамінніl‡ у | |||
|---|---|---|---|---|---|---|
| Археї | Бактерії | Еукаріоти | Людина | |||
| Alanine | GCU, GCC, GCA, GCG | 8.2 | 10.06 | 7.63 | 7.01 | Ні |
| Cysteine | UGU, UGC | 0.98 | 0.94 | 1.76 | 2.3 | Conditionally |
| Aspartic acid | GAU, GAC | 6.21 | 5.59 | 5.4 | 4.73 | Ні |
| Glutamic acid | GAA, GAG | 7.69 | 6.15 | 6.42 | 7.09 | Conditionally |
| Phenylalanine | UUU, UUC | 3.86 | 3.89 | 3.87 | 3.65 | Так |
| Glycine | GGU, GGC, GGA, GGG | 7.58 | 7.76 | 6.33 | 6.58 | Conditionally |
| Histidine | CAU, CAC | 1.77 | 2.06 | 2.44 | 2.63 | Так |
| Isoleucine | AUU, AUC, AUA | 7.03 | 5.89 | 5.1 | 4.33 | Так |
| Lysine | AAA, AAG | 5.27 | 4.68 | 5.64 | 5.72 | Так |
| Leucine | UUA, UUG, CUU, CUC, CUA, CUG | 9.31 | 10.09 | 9.29 | 9.97 | Так |
| Methionine | AUG | 2.35 | 2.38 | 2.25 | 2.13 | Так |
| Asparagine | AAU, AAC | 3.68 | 3.58 | 4.28 | 3.58 | Ні |
| Pyrrolysine | UAG* | 0 | 0 | 0 | 0 | Ні |
| Proline | CCU, CCC, CCA, CCG | 4.26 | 4.61 | 5.41 | 6.31 | Ні |
| Glutamine | CAA, CAG | 2.38 | 3.58 | 4.21 | 4.77 | Ні |
| Arginine | CGU, CGC, CGA, CGG, AGA, AGG | 5.51 | 5.88 | 5.71 | 5.64 | Conditionally |
| Serine | UCU, UCC, UCA, UCG, AGU, AGC | 6.17 | 5.85 | 8.34 | 8.33 | Ні |
| Threonine | ACU, ACC, ACA, ACG | 5.44 | 5.52 | 5.56 | 5.36 | Так |
| Selenocysteine | UGA** | 0 | 0 | 0 | >0 | Ні |
| Valine | GUU, GUC, GUA, GUG | 7.8 | 7.27 | 6.2 | 5.96 | Так |
| Tryptophan | UGG | 1.03 | 1.27 | 1.24 | 1.22 | Так |
| Tyrosine | UAU, UAC | 3.35 | 2.94 | 2.87 | 2.66 | Conditionally |
| Stop codon† | UAA, UAG, UGA†† | ? | ? | ? | Н/Д | Н/Д |
* UAG зазвичай є стоп-кодоном, але в організмах, що містять біологічний апарат, кодований кластером генів pylTSBCD, амінокислота піролізин буде включена.[9] ** UGA зазвичай є стоп-кодоном opal (або umber), але кодує селеноцистеїн, якщо присутній SECIS-елемент. † Стоп-кодон не є амінокислотою, але включено для повноти картини. †† UAG та UGA не завжди діють як стоп-кодони (див. вище). ‡ Незамінна амінокислота не може синтезуватися в організмі людини і тому повинна надходити з їжею. Умовно незамінні амінокислоти зазвичай не потрібні в раціоні, але повинні надходити екзогенно для певних груп населення, які не синтезують їх у достатніх кількостях. & Наявність амінокислот базується на протеомах 135 архей, 3775 бактерій, 614 еукаріот та протеомах людини (21 006 білків) відповідно.[10]
У мас-спектрометрії пептидів та білків корисним є знання мас залишків. Маса пептиду або білка дорівнює сумі мас залишків плюс маса води (моноізотопна маса = 18,01056 Да; середня маса = 18,0153 Да). Маси залишків обчислюються за табличними хімічними формулами та атомними вагами.[11] У мас-спектрометрії іони також можуть включати один або декілька протонів (моноізотопна маса = 1,00728 Да; середня маса* = 1,0074 Да). *Протони не можуть мати середньої маси, що призводить до плутанини, оскільки дейтрони є дійсним ізотопом, але вони повинні бути іншого виду (див. Гідрон (хімія)).
| Amino acid | Short | Abbrev. | Formula | Mon. mass§ (Da) | Avg. mass (Da) |
|---|---|---|---|---|---|
| Alanine | A | Ala | C3H5NO | 71.03711 | 71.0779 |
| Cysteine | C | Cys | C3H5NOS | 103.00919 | 103.1429 |
| Aspartic acid | D | Asp | C4H5NO3 | 115.02694 | 115.0874 |
| Glutamic acid | E | Glu | C5H7NO3 | 129.04259 | 129.1140 |
| Phenylalanine | F | Phe | C9H9NO | 147.06841 | 147.1739 |
| Glycine | G | Gly | C2H3NO | 57.02146 | 57.0513 |
| Histidine | H | His | C6H7N3O | 137.05891 | 137.1393 |
| Isoleucine | I | Ile | C6H11NO | 113.08406 | 113.1576 |
| Lysine | K | Lys | C6H12N2O | 128.09496 | 128.1723 |
| Leucine | L | Leu | C6H11NO | 113.08406 | 113.1576 |
| Methionine | M | Met | C5H9NOS | 131.04049 | 131.1961 |
| Asparagine | N | Asn | C4H6N2O2 | 114.04293 | 114.1026 |
| Pyrrolysine | O | Pyl | C12H19N3O2 | 237.14773 | 237.2982 |
| Proline | P | Pro | C5H7NO | 97.05276 | 97.1152 |
| Glutamine | Q | Gln | C5H8N2O2 | 128.05858 | 128.1292 |
| Arginine | R | Arg | C6H12N4O | 156.10111 | 156.1857 |
| Serine | S | Ser | C3H5NO2 | 87.03203 | 87.0773 |
| Threonine | T | Thr | C4H7NO2 | 101.04768 | 101.1039 |
| Selenocysteine | U | Sec | C3H5NOSe | 150.95364 | 150.0489 |
| Valine | V | Val | C5H9NO | 99.06841 | 99.1311 |
| Tryptophan | W | Trp | C11H10N2O | 186.07931 | 186.2099 |
| Tyrosine | Y | Tyr | C9H9NO2 | 163.06333 | 163.1733 |
§ Моноізотопна маса
У таблиці нижче наведено вміст амінокислот у клітинах E. coli та метаболічні витрати (АТФ) на синтез цих амінокислот. Від'ємні числа вказують на те, що метаболічні процеси є енергетично вигідними та не витрачають чистий АТФ клітини.[12] Надлишок амінокислот включає амінокислоти у вільній формі та у полімеризованій формі (білки).
| Амінокислота | Поширеність (# молекул (×108) на клітину E. coli ) |
ATФ вартість при синтезі | |
|---|---|---|---|
| Аеробні умови | Анаеробні умови | ||
| Alanine | 2.9 | −1 | 1 |
| Cysteine | 0.52 | 11 | 15 |
| Aspartic acid | 1.4 | 0 | 2 |
| Glutamic acid | 1.5 | −7 | −1 |
| Phenylalanine | 1.1 | −6 | 2 |
| Glycine | 3.5 | −2 | 2 |
| Histidine | 0.54 | 1 | 7 |
| Isoleucine | 1.7 | 7 | 11 |
| Lysine | 2.0 | 5 | 9 |
| Leucine | 2.6 | −9 | 1 |
| Methionine | 0.88 | 21 | 23 |
| Asparagine | 1.4 | 3 | 5 |
| Pyrrolysine | - | - | - |
| Proline | 1.3 | −2 | 4 |
| Glutamine | 1.5 | −6 | 0 |
| Arginine | 1.7 | 5 | 13 |
| Serine | 1.2 | −2 | 2 |
| Threonine | 1.5 | 6 | 8 |
| Selenocysteine | - | - | - |
| Valine | 2.4 | −2 | 2 |
| Tryptophan | 0.33 | −7 | 7 |
| Tyrosine | 0.79 | −8 | 2 |
- Примітки
| Амінокислота | Abbrev. | Remarks | |
|---|---|---|---|
| Alanine | A | Ala | Дуже поширений і дуже універсальний, він є більш щільним, ніж гліцин, але досить малим, щоб створювати лише невеликі стеричні обмеження для конформації білка. Він поводиться досить нейтрально та може розташовуватися як у гідрофільних ділянках білка ззовні, так і в гідрофобних областях усередині. |
| Asparagine or aspartic acid | B | Asx | Заповнювач, коли будь-яка амінокислота може займати певну позицію |
| Cysteine | C | Cys | Атом сірки легко зв'язується з іонами важких металів. В окиснювальних умовах два залишки цистеїну можуть утворювати дисульфідний зв'язок, утворюючи амінокислоту цистин. Коли цистини є складовою білка, наприклад інсуліну, формується стабільна третинна структура, що робить білок більш стійким до денатурації; саме тому дисульфідні зв'язки характерні для білків, які функціонують у суворих умовах, зокрема для травних ферментів (наприклад, пепсин і хімотрипсин) та структурних білків (наприклад, кератин). Дисульфідні зв'язки зустрічаються також у пептидах, які самі по собі не здатні утримувати стабільну конформацію (наприклад, інсулін). |
| Aspartic acid | D | Asp | Аспартат поводиться подібно до глутамінової кислоти, має гідрофільну кислотну групу з сильним негативним зарядом. Зазвичай знаходиться на зовнішній поверхні білка, завдяки білок він добре розчиняється у воді. Аспартат взаємодіє з молекулами й іонами з позитивним зарядом, і часто використовується в ферментах для фіксації іонів металу. Усередині білка залишки аспартату і глутамату зазвичай розташовуються у парі з аргініном і лізином. |
| Glutamic acid | E | Glu | Глутамінова кислота поводиться подібно до аспарагінової кислоти, але має довший і трохи більш гнучкий бічний ланцюг. |
| Phenylalanine | F | Phe | Життєво необхідні для людини фенілаланін, тирозин і триптофан містять у бічному ланцюгу велику, жорстку ароматичну групу. Вони є найбільшими амінокислотами. Як ізолейцин, лейцин і валін, ці амінокислоти є гідрофобними і, як правило, орієнтуються до внутрішньої частини згорнутої молекули білка. Фенілаланін може перетворюватися на тирозин. |
| Glycine | G | Gly | Через наявність двох атомів Гідрогену при α-вуглеці гліцин не проявляє оптичної активності. Це найменша амінокислота, яка легко обертається і забезпечує гнучкість білкового ланцюга. Вона може вписуватися в найтісніші ділянки, наприклад, у потрійну спіраль колагену. Оскільки надмірна гнучкість зазвичай небажана, як структурний компонент гліцин зустрічається рідше, ніж аланін. |
| Histidine | H | His | Гістидин є незамінною для людини амінокислотою. Навіть за слабо кислих умов відбувається протонування атома Нітрогену, що змінює властивості гістидину й поліпептиду загалом. Багато білків використовують цю властивість як регуляторний механізм, змінюючи конформацію й поведінку поліпептиду в кислих середовищах, як-от у пізніх ендосомах чи лізосомах, спричиняючи конформаційні зміни ферментів. Однак лише кілька залишків гістидину достатньо для такої функції, тому його в складі білків відносно мало. |
| Isoleucine | I | Ile | Ізолейцин є незамінною для людини амінокислотою. Ізолейцин, лейцин і валін мають великі аліфатичні гідрофобні бічні ланцюги. Їхні молекули жорсткі, а взаємодія між цими гідрофобними радикалами важлива для правильного згортання білків, оскільки ці ланцюги зазвичай розташовуються всередині молекули білка. Ізолейцин незамінний для людини. |
| Leucine or isoleucine | J | Xle | Заповнювач, коли будь-яка амінокислота може займати певну позицію |
| Lysine | K | Lys | Лізин є незамінною для людини амінокислотою і поводиться подібно до аргініну. Він має довгий, гнучкий бічний ланцюг із позитивно зарядженим кінцем. Завдяки гнучкості ланцюга лізин і аргінін здатні зв'язуватися з молекулами, поверхня яких містить багато негативних зарядів, наприклад, білки, що зв'язуються з ДНК, мають активні ділянки, багаті на аргінін і лізин. Сильний позитивний заряд обумовлює переважне розташування цих двох амінокислот на зовнішніх гідрофільних поверхнях білків; коли вони перебувають усередині, то, як правило, попарно з відповідною негативно зарядженою амінокислотою (аспартат або глутамат). |
| Leucine | L | Leu | Лейцин є незамінною для людини амінокислотою та поводиться подібно до ізолейцину і валіну. |
| Methionine | M | Met | Метіонін є незамінною для людини амінокислотою. Він завжди є першою амінокислотою, що вбудовується у білковий ланцюг, але іноді видаляється після трансляції. Як і цистеїн, метіонін містить сірку, але має метильну групу замість гідрогену. Ця метильна група може бути активована і використовується у багатьох реакціях, коли до іншої молекули приєднується новий атом карбону. |
| Asparagine | N | Asn | Подібний до аспарагінової кислоти, аспарагін містить амідну групу там, де у аспартату знаходиться карбоксильна група. |
| Pyrrolysine | O | Pyl | Подібний до лізину, але має приєднане пирролінове кільце. |
| Proline | P | Pro | Пролін містить незвичайне піролідинове кільце при N-кінцевій аміногрупі, що фіксує амідний CO–NH ланцюг у певній конформації. Це може порушувати структуру білка, наприклад, альфа-спіраль або бета-лист, спричиняючи необхідний вигин у поліпептидному ланцюзі. Багато його міститься в колагені, де пролін часто модифікується після трансляції у гідроксипролін. |
| Glutamine | Q | Gln | Як і глутамінова кислота, глутамін містить амідну групу там, де в глутамату карбоксильна. Він використовується у білках та як резервуар для аміаку, і є найпоширенішою амінокислотою в організмі. |
| Arginine | R | Arg | Функціонально подібний лізину. |
| Serine | S | Ser | Серин і треонін мають короткий бічний ланцюг, який завершується гідроксильною групою. Гідроген цієї групи легко відщеплюється, тому серин і треонін часто виконують роль донорів водню в ферментах. Обидві амінокислоти дуже гідрофільні, тому зовнішні ділянки розчинних білків зазвичай багаті на них. |
| Threonine | T | Thr | Незамінна для людини, поводить себе подібно серину. |
| Selenocysteine | U | Sec | Аналог цистеїну з селеном, де селен замінює атом сульфуру. |
| Valine | V | Val | Незамінна для людини, поводить себе подібно ізолейцину та лейцину. |
| Tryptophan | W | Trp | Триптофан є незамінною для людини амінокислотою і поводиться подібно до фенілаланіну і тирозину. Це попередник серотоніну й природний флуоресцент. |
| Unknown | X | Xaa | Позначення невідомої або неважливої амінокислоти. |
| Tyrosine | Y | Tyr | Тирозин поводиться подібно до фенілаланіну (який є його попередником) і триптофану, а також є попередником меланіну, адреналіну й тироїдних гормонів. Тирозин є природним флуоресцентом, хоча його флуоресценція зазвичай гаситься через енергетичний перенос до триптофану. |
| Glutamic acid or glutamine | Z | Glx | Заповнювач, коли будь-яка амінокислота може займати певну позицію |
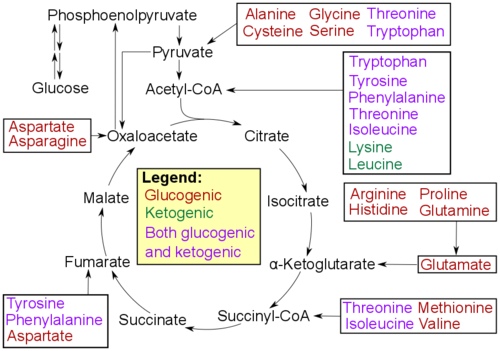
Амінокислоти можна класифікувати за властивостями їхніх основних продуктів:[13]
- Глюкогенні амінокислоти, коли продукти мають здатність утворювати глюкозу шляхом глюконеогенезу
- Кетогенні амінокислоти, коли продукти не здатні утворювати глюкозу: ці продукти все ще можуть використовуватися для кетогенезу або синтезу ліпідів.
- Амінокислоти, які катаболізуються як у глюкогенні, так і в кетогенні продукти
- ↑ Ambrogelly A, Palioura S, Söll D (January 2007). Natural expansion of the genetic code. Nature Chemical Biology. 3 (1): 29—35. doi:10.1038/nchembio847. PMID 17173027.
- ↑ Lobanov AV, Turanov AA, Hatfield DL, Gladyshev VN (August 2010). Dual functions of codons in the genetic code. Critical Reviews in Biochemistry and Molecular Biology. 45 (4): 257—65. doi:10.3109/10409231003786094. PMC 3311535. PMID 20446809.
- ↑ Young VR (August 1994). Adult amino acid requirements: the case for a major revision in current recommendations (PDF). The Journal of Nutrition. 124 (8 Suppl): 1517S—1523S. doi:10.1093/jn/124.suppl_8.1517S. PMID 8064412.
- ↑ Erives A (August 2011). A model of proto-anti-codon RNA enzymes requiring L-amino acid homochirality. Journal of Molecular Evolution. 73 (1–2): 10—22. Bibcode:2011JMolE..73...10E. doi:10.1007/s00239-011-9453-4. PMC 3223571. PMID 21779963.
- ↑ Frenkel-Pinter, Moran; Haynes, Jay W.; C, Martin; Petrov, Anton S.; Burcar, Bradley T.; Krishnamurthy, Ramanarayanan; Hud, Nicholas V.; Leman, Luke J.; Williams, Loren Dean (13 серпня 2019). Selective incorporation of proteinaceous over nonproteinaceous cationic amino acids in model prebiotic oligomerization reactions. Proceedings of the National Academy of Sciences (англ.). 116 (33): 16338—16346. Bibcode:2019PNAS..11616338F. doi:10.1073/pnas.1904849116. ISSN 0027-8424. PMC 6697887. PMID 31358633.
- ↑ Thurlkill RL, Grimsley GR, Scholtz JM, Pace CN (May 2006). pK values of the ionizable groups of proteins. Protein Science. 15 (5): 1214—8. doi:10.1110/ps.051840806. PMC 2242523. PMID 16597822.
- ↑ Pace CN, Grimsley GR, Scholtz JM (May 2009). Protein ionizable groups: pK values and their contribution to protein stability and solubility. The Journal of Biological Chemistry. 284 (20): 13285—9. doi:10.1074/jbc.R800080200. PMC 2679426. PMID 19164280.
- ↑ Byun BJ, Kang YK (May 2011). Conformational preferences and pK(a) value of selenocysteine residue. Biopolymers. 95 (5): 345—53. doi:10.1002/bip.21581. PMID 21213257.
- ↑ Rother M, Krzycki JA (August 2010). Selenocysteine, pyrrolysine, and the unique energy metabolism of methanogenic archaea. Archaea. 2010: 1—14. doi:10.1155/2010/453642. PMC 2933860. PMID 20847933.
- ↑ Kozlowski LP (January 2017). Proteome-pI: proteome isoelectric point database. Nucleic Acids Research. 45 (D1): D1112—D1116. doi:10.1093/nar/gkw978. PMC 5210655. PMID 27789699.
- ↑ Atomic Weights and Isotopic Compositions for All Elements. NIST. Процитовано 12 грудня 2016.
- ↑ Physical biology of the cell (вид. Second). Garland Science. 2013. с. 178. ISBN 978-0-8153-4450-6.
- ↑ Chapter 20: Amino Acid Degradation and Synthesis. Lippincott's Illustrated Reviews: Biochemistry (Lippincott's Illustrated Reviews). Hagerstwon, MD: Lippincott Williams & Wilkins. 2005. ISBN 978-0-7817-2265-0.