주기율표

| 주기율표 |
|---|
주기율표(週期律表, 영어: periodic table) 또는 원소 주기율표는 화학 원소를 가로줄("주기")과 세로줄("족")로 정렬한 표이다.[1] 화학의 상징이자 물리학 및 기타 과학 분야에서도 널리 사용된다. 주기율표는 화학 원소의 주기율을 보여주는 사례로, 원소를 원자 번호 순서로 배열하면 그들의 성질이 대략적으로 반복된다. 주기율표는 구역이라고 불리는 네 개의 대략 직사각형 영역으로 나뉜다. 같은 족에 속하는 원소는 비슷한 화학적 특성을 보인다.
주기율표의 특징으로 수직적, 수평적, 그리고 대각선에 따라서 비슷한 성질을 보이는 경향이 있다. 금속 특성은 족을 따라 아래로 갈수록, 그리고 주기를 따라 오른쪽에서 왼쪽으로 갈수록 증가한다. 비금속 특성은 주기율표의 왼쪽 아래에서 오른쪽 위로 갈수록 증가한다.
일반적으로 받아들여진 최초의 주기율표는 러시아 화학자 드미트리 멘델레예프가 1869년에 만든 것으로, 멘델레예프는 원자 질량에 대한 화학적 특성의 주기성으로 주기율을 공식화했다. 당시 모든 원소가 알려져 있지 않았기 때문에 멘델레예프의 주기율표에는 빈칸이 있었고, 멘델레예프는 주기율을 이용하여 일부 미지 원소의 특성을 예측했다. 주기율은 19세기 후반에 근본적인 발견으로 인정받았다. 20세기 초반에 원자 번호와 관련된 선구적인 양자역학의 발견으로 화학의 주기율 특성을 설명할 수 있게 되었으며, 이 두 아이디어는 원자의 내부 구조를 밝히는 데 기여했다. 1945년 글렌 T. 시보그가 악티늄족이 실제로 d-구역이 아닌 f-구역 원소라는 것을 발견하면서 현대적인 형태의 주기율표가 완성되었다. 주기율표와 주기율은 이제 현대 화학의 핵심적이고 필수적인 부분이다.
주기율표는 과학의 발전에 따라 계속 진화하고 있다. 자연에는 원자 번호 94번까지의 원소까지만 존재한다.[a] 더 높은 원자 번호의 원소를 얻기 위해서는 실험실에서 새로운 원소를 합성해야 한다. 2010년 기준 처음 118개 원소가 알려져 주기율표의 첫 7개 줄을 완성했다.[2] 하지만 가장 무거운 원소의 특성이 그 위치와 일치하는지 확인하기 위한 화학적 특성화는 아직 연구가 더 필요하다. 새로운 원소가 발견된다면 주기율표를 이 일곱 줄을 넘어 확장할 수 있게 되지만 얼마나 더 많은 원소가 합성이 가능한지는 아직 알려지지 않았다. 게다가 이론적 계산에 따르면 이 미지의 영역은 지금까지 알려진 주기율표의 패턴을 따르지 않을 것이라고 한다. 현재는 주기율표에서 일부 원소의 위치가 정확한지 여부에 대한 과학적 논의가 계속 이루어지고 있다. 또한 주기율에는 많은 다른 표현이 존재하며, 주기율표의 최적 형태가 있는지에 대한 논의도 있다.
구조
[편집]
각 화학 원소는 원자핵에 있는 양성자 수를 나타내는 고유한 원자 번호(Z, 독일어로 "수"를 뜻하는 "Zahl"의 약자)를 가진다.[5] 따라서 각기 다른 원자 번호는 화학 원소라고 불리는 특정 유형의 원자에 해당한다.[6] 주기율표가 분류하고 조직하는 것이 바로 이 화학 원소이다. 수소는 원자 번호 1인 원소이고, 헬륨은 원자 번호 2, 리튬은 원자 번호 3 등으로 매겨진다. 이러한 각 이름은 한두 글자의 원소 기호로 더 줄여 쓸 수 있으며, 수소, 헬륨, 리튬의 기호는 각각 H, He, Li이다.[7] 중성자는 원자의 화학 정체성에 영향을 미치지 않지만, 그 무게에는 영향을 미친다. 양성자 수는 같지만 중성자 수가 다른 원자를 같은 화학 원소의 동위 원소라고 한다.[7] 자연에 존재하는 원소는 보통 서로 다른 동위 원소의 혼합물로 존재한다. 각 동위 원소는 특정한 존재비를 가지므로, 자연에 있는 원소는 그 원소의 자연에 있는 모든 동위 원소 원자의 평균 질량으로 정의되는 잘 정의된 표준 원자량을 가진다.[8] 모든 원소는 같은 수의 양성자를 가지지만 서로 다른 수의 중성자를 가진 다양한 동위 원소를 가진다. 예를 들어 탄소는 세 가지 자연 발생 동위 원소를 가진다. 모든 탄소 원자는 여섯 개의 양성자를 가지고 있으며 대부분 여섯 개의 중성자도 가지지만, 약 1%는 일곱 개의 중성자를 가지고 있고, 매우 소량으로 여덟 개의 중성자를 가지는 동위 원소가 있다. 동위 원소는 주기율표에서 따로 분리해 표기하지 않는다. 항상 하나의 원소 아래에 함께 분류된다. 주기율표에 원자 질량을 표기할 땐 보통 자연에 존재하는 동위 원소의 가중 평균치를 사용한다. 그러나 자연에 상당한 양의 동위 원소가 존재하지 않는 경우, 가장 안정한 동위 원소의 질량을 종종 괄호 안에 표시한다.[9]
표준 주기율표에서는 원소가 증가하는 원자 번호 순서로 나열되어 있다. 새로운 줄(주기)은 새로운 전자 껍질에 첫 번째 전자가 채워질 때 시작된다. 열(족)은 원자의 전자 배열에 따라 결정된다. 특정 부껍질에 같은 수의 전자를 가진 원소들은 같은 열에 속한다. 예를 들어 산소, 황, 셀레늄은 모두 가장 바깥쪽 p-부껍질에 네 개의 전자를 가지고 있기 때문에 같은 열에 속한다. 주기율표에서 비슷한 화학적 특성을 가진 원소는 일반적으로 같은 족에 속하지만, f-구역과 일부 d-구역에서는 같은 주기에 있는 원소들도 비슷한 특성을 보이는 경향이 있다. 따라서 어떤 원소의 화학적 특성을 그 주변 원소의 특성만 알면 비교적 쉽게 예측할 수 있다.[10]
현재까지 118개의 원소가 알려져 있으며, 이 중 처음 94개는 현재 지구상에 자연적으로 존재한다고 알려져 있다.[11][a] 나머지 24개, 아메리슘부터 오가네손(95~118)까지는 실험실에서 합성될 때만 생성된다. 94개의 자연 발생 원소 중 83개는 원시 원소이며, 11개는 원시 원소의 붕괴 과정에서만 발생한다. 후자 중 일부는 너무 희귀하여 자연에서 발견되지 않고 실험실에서 합성되었지만 나중에 자연에도 존재한다는 것이 밝혀졌다. 대표적으로 테크네튬(원자번호 43), 프로메튬(원자번호 61), 아스타틴(원자번호 85), 넵투늄(원자번호 93), 플루토늄(원자번호 94)이 있다.[13] 아인슈타이늄(원자번호 99)보다 무거운 원소나 아스타틴은 순수한 형태로 거시적인 양으로 관찰된 적이 없으며, 프랑슘(원자번호 87)은 미시적인 양(30만 개의 원자)에서 방출된 빛의 형태로만 사진이 찍혔다.[15] 94개의 자연 원소 중 80개는 안정 동위 원소를 가지고 있으며, 1개(비스무트)는 거의 안정적인 동위 원소를 가지고 있다(반감기 2.01×1019년, 우주의 나이보다 10억 배 이상 길다).[16][b] 두 개 (토륨과 우라늄)는 방사성 붕괴를 겪는 동위 원소를 가지며, 그 반감기는 지구의 나이와 비슷하다. 안정 원소와 비스무트, 토륨, 우라늄은 지구 형성 이후 살아남은 83개의 원시 원소를 구성한다.[c] 나머지 11개의 자연 원소는 빠르게 붕괴하지만 주로 토륨과 우라늄 붕괴의 중간 생성물로 끊임없이 재생성되어 자연상에서 미량으로 계속 존재한다.[d] 알려진 24개의 인공 원소는 모두 방사성이다.[7]
족 이름과 번호
[편집]국제 명명 규칙에 따라 족은 가장 왼쪽 열(알칼리 금속)부터 가장 오른쪽 열(비활성 기체)까지 1부터 18까지 숫자로 매겨진다. f-구역 족은 이 번호 매김에서 빠진다.[23] 족은 첫 번째 원소의 이름을 따서 명명할 수도 있다. 예를 들어 3족은 "스칸듐족"으로 불린다.[23] 이전에는 족이 로마 숫자로 알려져 있었다. 미국에서는 로마 숫자 뒤에 족이 s- 또는 p-구역에 있으면 "A"를, 족이 d-구역에 있으면 "B"를 붙였다. 사용된 로마 숫자는 오늘날의 명명 규칙의 마지막 자릿수와 일치한다(예: 4족 원소는 IVB족이었고, 14족 원소는 IVA족이었다). 유럽에서는 문자 표기가 비슷했지만, 1족부터 7족까지는 "A"를, 11족부터 17족까지는 "B"를 사용했다. 또한 8족, 9족, 10족은 예전에는 하나의 세 배 크기 족으로 취급되었으며, 두 표기법 모두에서 VIII족으로 통칭되었다. 1988년에 새로운 IUPAC(International Union of Pure and Applied Chemistry) 명명 체계(1~18)가 사용되기 시작했으며, 이전의 족 이름(I~VIII)은 폐기되었다.[24]
| IUPAC 족 | 1a | 2 | —b | 3c | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 멘델레예프 (I–VIII) | I | II | III | IV | V | VI | VII | VIII | I | II | III | IV | V | VI | VII | d | |||
| CAS (미국, A-B-A) | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |||
| 구 IUPAC (유럽, A-B) | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIII | IB | IIB | IIIB | IVB | VB | VIB | VIIB | 0 | |||
| 관용명r | H 및 알칼리 금속 | 알칼리 토금속 | 트리엘 | 테트렐 | 프닉토젠 | 칼코젠 | 할로젠 | 비활성 기체 | |||||||||||
| 원소별 명칭r | 리튬족 | 베릴륨족 | 스칸듐족 | 타이타늄족 | 바나듐족 | 크로뮴족 | 망가니즈족 | 철족 | 코발트족 | 니켈족 | 구리족 | 아연족 | 붕소족 | 탄소족 | 질소족 | 산소족 | 플루오린족 | 헬륨 또는 네온족 | |
| 1주기 | H | He | |||||||||||||||||
| 2주기 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| 3주기 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| 4주기 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| 5주기 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| 6주기 | Cs | Ba | La–Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7주기 | Fr | Ra | Ac–No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
b 14개의 f-블록 족(열)은 족 번호가 없다.
c 3족의 올바른 구성은 여기에 표시된 스칸듐(Sc), 이트륨(Y), 루테튬(Lu), 로렌슘(Lr)으로, 이는 1988년[24]과 2021년[25] IUPAC 보고서에서 정의한 내용이다. 일반 무기화학 교재에서는 종종 스칸듐(Sc), 이트륨(Y), 란타넘(La), 악티늄(Ac)을 3족에 넣는데, 이 경우 Ce-Lu와 Th-Lr이 3족과 4족 사이의 f-블록이 된다. 이는 역사적으로 부정확하게 측정된 전자 배치에 기반한 것으로,[26] 레프 란다우와 예브게니 리프시츠는 이미 1948년에 이를 부정확하다고 간주했다.[27] 오늘날의 문헌에서도 이를 옹호하려는 주장이 여전히 가끔 발견되지만, 대부분의 저자는 이를 논리적으로 일관되지 않다고 본다.[28][29][30] 일부 출처는 La-Lu와 Ac-Lr을 f-블록 행으로 배치하는 절충안을 따르는데 (이는 각 행에 15개의 f-블록 원소를 넣어버려 양자역학과 모순됨에도 불구하고), 3족의 더 무거운 원소는 모호하게 남겨둔다.[25] 3족 원소#구성을 참조하라.
d 18족인 비활성 기체는 멘델레예프의 원래 주기율표가 만들어졌을 당시에는 발견되지 않았다. 나중에 (1902년) 멘델레예프는 비활성 기체의 존재 증거를 받아들였고, 주기율표 원칙을 깨지 않고 일관되게 새로운 "0족"에 배치될 수 있었다.
r IUPAC에서 권장하는 족 이름.
표시 형식
[편집]공간상의 이유로,[31][32] 주기율표는 일반적으로 f-구역 원소들이 잘려져 본 표 아래에 별도의 부분으로 배치되어 표시된다.[33][31][24] 이는 원소 열의 수를 32개에서 18개로 줄인다.[31]
옆에 제시된 표는 주기율표를 표시하는 두 가지 방법이다.[7] f-구역이 본체에 포함된 형태는 때때로 32열[7] 또는 긴 형태라고 불린다.[34] f-구역이 잘려진 형태는 18열[7] 또는 중간 길이 형태라고 불린다.[34] 32열 형태는 모든 원소를 올바른 순서로 보여주는 장점이 있지만, 더 많은 공간을 필요로 하는 단점이 있다.[35] 어떤 형태를 선택할지는 편집 상의 문제이며, 어떠한 과학적 주장이나 진술의 차이를 의미하지 않는다. 예를 들어, 3족의 구성을 논의할 때, 두 가지 형태 모두에서 선택 사항을 동등하게 (편견 없이) 보여줄 수 있다.[36]
일반적으로 주기율표에는 원소 기호가 표기된다. 또한 많은 주기율표에서 색상 코딩 또는 셀 내의 데이터 표기로 원소에 대한 추가 정보를 제공한다. 위 표는 원소의 이름과 원자 번호, 원소기 속한 구역, 자연에서 발견 가능 여부, 표준 원자량을 보여준다. 표준 원자량이 없는 짧은 수명의 원소의 경우, 가장 안정한 것으로 알려진 동위 원소의 질량수가 대신 사용된다. 그 외에도 물질의 상태, 끓는점과 녹는점, 밀도와 같은 특성뿐만 아니라 원소의 다양한 분류도 기록할 수 있다.[e]
전자 배열
[편집]주기율표는 주기율을 그림으로 표현한 것이다.[37] 주기율은 화학 원소의 성질과 원자 구조가 원자 번호의 주기함수로 반복된다는 뜻이다.[38] 원소는 원자의 전자 배열에 따라 주기율표에 배치되며,[39] 이러한 전자 배열의 주기적 반복은 주기율표 전반의 경향을 설명한다.[40]
전자는 원자 궤도에 존재한다고 볼 수 있으며, 이는 원자 주변의 특정 영역에서 전자가 발견될 확률을 나타낸다. 전자의 에너지는 양자화되어 있는데 이는 에너지가 불연속적인 특정 값만을 가질 수 있다는 말이다. 또한 전자는 서로 다른 전자는 항상 다른 상태에 있어야 한다는 파울리 배타 원리를 따른다. 이를 통해 전자가 껍질이라고 알려진 다양한 에너지 준위에서 취할 수 있는 가능한 상태로 분류할 수 있다. 각 껍질은 개별의 부껍질로 나뉘고, 각 부껍질은 하나 이상의 궤도를 가지고 있다. 각 궤도는 최대 두 개의 전자를 가질 수 있다. 이는 스핀이라고 알려진 양으로 구별되며, 보통 "위" 또는 "아래"로 표시한다.[41][f] 차가운 원자(바닥 상태에 있는 원자)에서는 전자가 사용 가능한 가장 낮은 에너지 궤도를 차지하여 총 에너지가 최소화되도록 배열된다.[43] 오직 가장 바깥쪽 전자(소위 원자가 전자)만이 핵으로부터 벗어나 다른 원자와 화학 반응에 참여할 수 있을 만큼 충분한 에너지를 가진다. 나머지 전자는 내부 전자라고 불린다.[44]
| ℓ = | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 껍질 갯수 (2n2)[45] |
|---|---|---|---|---|---|---|---|---|
| 궤도 | s | p | d | f | g | h | i | |
| n = 1 | 1s | 2 | ||||||
| n = 2 | 2s | 2p | 8 | |||||
| n = 3 | 3s | 3p | 3d | 18 | ||||
| n = 4 | 4s | 4p | 4d | 4f | 32 | |||
| n = 5 | 5s | 5p | 5d | 5f | 5g | 50 | ||
| n = 6 | 6s | 6p | 6d | 6f | 6g | 6h | 72 | |
| n = 7 | 7s | 7p | 7d | 7f | 7g | 7h | 7i | 98 |
| 부껍질 갯수 (4ℓ+2) | 2 | 6 | 10 | 14 | 18 | 22 | 26 | |
현재까지 알려진 원소는 최대 일곱 번째 껍질까지 채워진 상태로 존재한다. 첫 번째 껍질은 하나의 구형 s 궤도만 가지고 있다. 첫 번째 껍질에 있기 때문에 이를 1s 궤도라고 부른다. 이 궤도는 최대 두 개의 전자를 가질 수 있다. 두 번째 껍질도 마찬가지로 2s 궤도를 가지고 있으며, 세 개의 아령 모양 2p 궤도도 포함해 최대 여덟 개의 전자를 채울 수 있다 (2×1 + 2×3 = 8). 세 번째 껍질은 하나의 3s 궤도, 세 개의 3p 궤도, 다섯 개의 3d 궤도를 포함하여 2×1 + 2×3 + 2×5 = 18개의 전자를 가질 수 있다. 네 번째 껍질은 하나의 4s 궤도, 세 개의 4p 궤도, 다섯 개의 4d 궤도, 일곱 개의 4f 궤도를 포함하여 2×1 + 2×3 + 2×5 + 2×7 = 32개의 전자를 가질 수 있다.[31] 더 높은 껍질은 패턴을 반복해 더 많은 유형의 궤도를 가지고 있지만, 그러한 유형의 궤도는 알려진 원소의 바닥 상태에서부터 채워지지 않는다.[46] 부껍질 유형은 양자수로 특징을 집을 수 있다. 주양자수 n, 방위 양자수 ℓ (궤도 유형), 궤도 자기 양자수 mℓ, 스핀 자기 양자수 ms 이 4가지 숫자로 원자 궤도를 완전히 설명할 수 있다.[40]
부껍질 채움 순서
[편집]
부껍질이 채워지는 순서는 대부분의 경우 쌓음 원리를 따라간다. 이는 마델룽 규칙 또는 클레치콥스키 규칙(각각 에르빈 마델룽과 프세볼로트 클레치콥스키의 이름을 따서 명명됨)으로도 알려져 있다. 이 규칙은 마델룽이 처음 경험칙으로 주장했으며, 클레치콥스키와 이후 저자가 이론적으로 경험칙이 맞음을 증명했다.[47][48][49][50][g] 껍질은 에너지 범위가 서로 약간씩 겹치며, 쌓음 원리에 따르면 부껍질은 다음과 같이 채워진다.[48]
- 1s ≪ 2s < 2p ≪ 3s < 3p ≪ 4s < 3d < 4p ≪ 5s < 4d < 5p ≪ 6s < 4f < 5d < 6p ≪ 7s < 5f < 6d < 7p ≪ ...
여기서 ≪ 기호는 "매우 격차가 크다"는 의미로, < 기호의 단순히 "앞의 것이 작다"는 의미와 크게 다르다.[48] 다르게 표현하면, 전자는 n + ℓ 값이 증가하는 순서로 궤도에 들어가고, 같은 n + ℓ 값을 가진 두 궤도가 있다면 n 값이 낮은 궤도가 먼저 채워진다.[46][50] 보통 n + ℓ 값이 같은 궤도는 에너지가 서로 비슷하지만 s 궤도(ℓ = 0)의 경우 양자 효과 때문에 에너지가 다음 n + ℓ 그룹과 가까워진다. 따라서 주기율표는 보통 새로운 s 궤도가 채워지는 것으로 각 줄(종종 주기라고 불림)을 시작하도록 그려지며, 이는 새로운 껍질의 시작에 해당한다.[48][49][31] 따라서 첫 번째 줄을 제외하고 각 주기의 길이는 아래와 같이 두 번싹 나타난다.[48]
- 2, 8, 8, 18, 18, 32, 32, ...
d 궤도가 나타나는 지점에서는 에너지 겹침이 상당히 가까워지고,[51] 원자 번호[52]와 원자 전하에 따라 순서가 약간식 서로 바뀔 수 있다.[53][h]
가장 단순한 원자부터 시작해 단일한 원자의 경우를 고려하여 원자 번호 순서로 주기율표를 하나씩 구성할 수 있다. 수소에는 전자가 하나뿐이므로 가장 낮은 에너지 궤도인 1s에 들어가야 한다. 이 전자 배열은 1s1로 표기되며, 위첨자는 부껍질에 있는 전자 수를 나타낸다. 헬륨은 두 번째 전자가 추가되는데 이 전자 또한 1s에 들어가 첫 번째 껍질을 완전히 채우며 1s2 배열을 형성한다.[40][59][i]
세 번째 원소인 리튬부터는 첫 번째 껍질이 가득 차므로, 세 번째 전자는 2s 궤도를 차지하여 1s2 2s1 배열을 이룬다. 2s 전자는 리튬의 유일한 원자가 전자이며, 1s 부껍질은 이제 핵에 너무 강하게 결합되어 다른 원자와 화학 결합에 참여할 수 없게 된다. 이러한 껍질을 "내부 껍질"이라고 부른다. 1s 부껍질은 리튬 이후 모든 원소에서 내부 껍질이다. 2s 부껍질은 다음 원소인 베릴륨(1s2 2s2)에서 완성된다. 그 다음 원소는 2p 부껍질을 채우기 시작한다. 붕소(1s2 2s2 2p1)는 새로운 전자를 2p 궤도에 넣고, 탄소(1s2 2s2 2p2)는 두 번째 2p 궤도를 채우며, 질소(1s2 2s2 2p3)에서는 세 개의 2p 궤도가 모두 단일한 방향으로 점유하는 상태가 된다. 이는 원자가 보통 각 궤도를 두 번째 전자로 채우기 전에는 동일한 유형의 각 궤도를 하나씩 점유하는 것을 선호한다는 훈트의 최대 다중도 규칙에 따른 것이다. 산소(1s2 2s2 2p4), 플루오린(1s2 2s2 2p5), 네온(1s2 2s2 2p6)은 이미 단일한 방향으로 점유된 2p 궤도에 전자가 하나씩 차면서 완성하며 이 중 마지막 원소인 네온은 두 번째 껍질을 완전히 채운다.[40][59]
11번 원소인 나트륨부터는 두 번째 껍질이 가득 차서, 이 원소와 그보다 무거운 모든 원소에 대해 두 번째 껍질은 내부 껍질이 된다. 11번째 전자는 3s 궤도를 채우기 시작하여 나트륨의 전자 배열은 1s2 2s2 2p6 3s1이 된다. 이 배열은 [Ne] 3s1로 줄여 쓰며, 여기서 [Ne]은 네온의 배열을 나타낸다. 마그네슘 ([Ne] 3s2)은 이 3s 궤도를 완성하고, 다음 여섯개 원소인 알루미늄, 규소, 인, 황, 염소, 아르곤은 세 개의 3p 궤도를 채운다 ([Ne] 3s2 3p1에서 [Ne] 3s2 3p6까지 이어진다).[40][59] 이는 나트륨부터 아르곤까지의 바깥 껍질 구조가 리튬부터 네온까지의 구조와 유사한 일련의 원소를 이루며, 이는 주기율표가 보여주는 화학적 특성의 주기성의 기초가 된다.[40] 즉, 원자 번호에 따라 규칙적이지만 변화하는 간격으로 화학 원소의 특성이 대략적으로 반복된다.[37]
따라서 처음 18개 원소는 주기율표의 시작 부분으로 배열될 수 있다. 같은 열에 있는 원소는 같은 수의 원자가 전자를 가지며 유사한 원자가 전자 배열을 가진다. 이러한 열을 족이라고 부른다. 유일한 예외는 헬륨인데, 헬륨은 베릴륨과 마그네슘처럼 두 개의 원자가 전자를 가지지만 보통 네온과 아르곤이 속한 열에 배치되어 바깥 껍질이 가득 찼다는 것을 강조한다. (일부 현대 저자는 심지어 이 유일한 예외에도 의문을 제기하며, 일관되게 원자가 배열을 따라야 한다고 주장해 헬륨을 베릴륨 위에 배치하는 것을 선호한다.) 이 주기율표 부분에는 8개의 열이 있으며, 이는 최대 8개의 바깥 껍질 전자에 해당한다.[33] 새로운 껍질이 채워지기 시작하면 새로운 주기가 시작된다.[31] 마지막으로 각 색깔은 구역을 나타낸다. s-구역(빨간색)의 원소는 s 궤도를 채우고, p-구역(노란색)의 원소는 p 궤도를 채운다. 그렇게 그린 주기율표는 아래와 같다.[31]
| 1 H |
2 He |
2×1 = 2개 원소 1s | ||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2×(1+3) = 8개 원소 2s 2p |
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
2×(1+3) = 8개 원소 3s 3p |
다음 줄안 칼륨과 칼슘의 경우 4s 부껍질이 가장 낮은 에너지에 있으므로 여기부터 채워진다.[40][59] 칼륨은 4s 껍질에 전자 하나를 추가하고([Ar] 4s1), 칼슘은 이를 완성한다([Ar] 4s2). 하지만 스칸듐 ([Ar] 3d1 4s2)부터는 3d 부껍질이 그 다음으로 높은 에너지에 놓인다. 4s와 3d 부껍질은 에너지가 거의 같아서 전자 채우기에 서로 경쟁하며, 따라서 3d 궤도가 한 번에 하나씩 일관되게 채워지지는 않는다. 3d와 4s의 정확한 에너지 순서는 줄을 따라 변하며, 원자에서 빠지는 전자 수에 따라 변하기도 한다. 예를 들어, 3d 전자와 4s 전자 사이의 반발 때문에 크로뮴에서는 4s 에너지 준위가 3d보다 약간 높아져 [Ar] 3d5 4s1 배열을 가지는 것이 [Ar] 3d4 4s2 배열보다 더 유리해진다. 비슷한 이상 현상이 구리에서도 발생하는데, 구리 원자는 법칙에 따른 [Ar] 3d9 4s2 대신 [Ar] 3d10 4s1 배열을 가진다.[40] 이런 배열이 쌓음 원리의 예외이다. 하지만 이러한 이상 현상은 화학적으로 큰 의미를 가지지 않는다.[53] 대부분의 화학은 고립된 기체 원자에 관한 반응을 보지 않으며,[61] 다양한 배열이 서로 에너지가 매우 가까워서[51] 근처 원자의 존재가 균형을 바꿀 수 있다.[40] 따라서 주기율표는 이러한 예외를 무시하고 이상화된 배열만 고려한다.[39]
아연 ([Ar] 3d10 4s2)에서 3d 궤도는 총 10개의 전자로 완전히 채워진다.[40][59] 다음으로는 4p 궤도가 나오는데, 이는 한 줄을 완성하며 갈륨 ([Ar] 3d10 4s2 4p1)부터 크립톤 ([Ar] 3d10 4s2 4p6)까지 이전 p-구역 원소와 유사한 방식으로 점진적으로 채워진다.[40][59] 갈륨 이후부터는 3d 궤도가 전자가 내부 껍질에 속하게 되며 더 이상 화학 반응에 참여하지 않는다.[58] 바깥 껍질을 채우는 s- 및 p-구역 원소는 전형 원소라고 불린다. 내부 껍질을 채우는 d-구역 원소(아래 파란색)는 전이 원소 (또는 모두 금속이므로 전이 금속)이라고 불린다.[62]
다음 18개 원소는 5s 궤도(루비듐과 스트론튬), 그 다음 4d 궤도(이트륨에서 카드뮴까지, 역시 중간에 몇 가지 이상 현상이 있음), 마지막으로 5p 궤도(인듐에서 제논까지)를 채운다.[31][59] 다시 말하지만, 인듐부터는 4d 궤도가 내부 껍질에 있다.[59][63] 따라서 다섯 번째 줄은 네 번째 줄과 같은 구조를 가진다.[31]
| 1 H |
2 He |
2×1 = 2개 원소 1s | ||||||||||||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2×(1+3) = 8개 원소 2s 2p | ||||||||||
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
2×(1+3) = 8개 원소 3s 3p | ||||||||||
| 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
2×(1+3+5) = 18개 원소 4s 3d 4p |
| 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
2×(1+3+5) = 18개 원소 5s 4d 5p |
주기율표의 여섯 번째 줄도 마찬가지로 두 개의 s-구역 원소인 세슘과 바륨으로 시작한다.[59] 그 다음부터는 란타넘부터 시작하는 첫 번째 f-구역 원소(아래 녹색)가 나타나기 시작한다. 이들은 때때로 내부 전이 원소라고 불린다.[62] 이제 4f뿐만 아니라 5d와 6s 부껍질도 비슷한 에너지에 존재하므로, 다시 수많은 불규칙한 배열이 나오며 서로간 경쟁이 발생한다.[51] 이 때문에 f-구역이 정확히 어디에서 시작되어야 하는지에 대한 논쟁이 있었지만, 이 문제를 연구하는 대부분의 사람들은 쌓음 원리에 따라 란타넘에서 시작한다는 데 동의한다.[64] 란타넘 자체는 단일 원자로 4f 부껍질을 채우지는 않지만, 전자 간의 반발 때문에[53] 4f 궤도는 화학 반응에 참여할 수 있을 만큼 충분히 낮은 에너지에 있다.[65][54][66] 이터븀에서 7개의 4f 궤도는 14개의 전자로 완전히 채워진다. 그 후, 10개의 전이 원소(루테튬부터 수은까지)가 뒤따르고,[59][67][68][69] 마지막으로 6개의 주족 원소(탈륨부터 라돈까지)가 주기를 완성한다.[59][70] 루테튬 이후부터는 4f 궤도가 코어에 있으며,[59][66] 탈륨 이후부터는 5d 궤도도 코어에 있다.[59][58][71]
주기율표의 일곱 번째 줄은 여섯 번째 줄과 유사하다. 7s 궤도(프랑슘과 라듐)가 채워지고, 이어서 5f 궤도(악티늄부터 노벨륨까지), 그 다음 6d 궤도(로렌슘부터 코페르니슘까지), 마지막으로 7p 궤도(니호늄부터 오가네손까지)가 채워진다.[59] 로렌슘부터는 5f 궤도가 내부 껍질에 있으며,[59] 아마도 니호늄부터는 6d 궤도도 내부 껍질에 포함될 것이다.[59][72][j] 다시 중간에 몇 가지 이상 현상이 나타난다.[31] 예를 들어, 단일 원자로는 악티늄과 토륨도 실제로는 5f 부껍질을 채우지 않으며, 로렌슘도 6d 껍질을 채우지 않지만 이 모든 부껍질은 다양한 화학 환경에서 채워질 수 있다.[74][75][76] 아주 오랫동안 일곱 번째 줄은 불완전했는데, 이 줄의 원소 대부분이 자연에 존재하지 않기 때문이었다. 누락된 초우라늄 원소는 1940년 넵투늄이 만들어지면서 실험실에서 인공적으로 합성되기 시작했다.[77] (그러나 자연이 아닌 합성으로 발견된 최초의 원소는 1937년의 테크네튬이었다.) 이 줄은 2010년 테네신 합성으로 완성되었고[78] (마지막 원소 오가네손은 이미 2002년에 만들어졌다),[79] 이 일곱 번째 줄의 마지막 원소들은 2016년에 이름이 모두 붙여졌다. 그렇게 완성된 주기율표는 아래와 같다.[80]
| 1 H |
2 He |
2×1 = 2개 원소 1s | ||||||||||||||||||||||||||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2×(1+3) = 8개 원소 2s 2p | ||||||||||||||||||||||||
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
2×(1+3) = 8개 원소 3s 3p | ||||||||||||||||||||||||
| 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
2×(1+3+5) = 18개 원소 4s 3d 4p | ||||||||||||||
| 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
2×(1+3+5) = 18개 원소 5s 4d 5p | ||||||||||||||
| 55 Cs |
56 Ba |
57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
2×(1+3+5+7) = 32개 원소 6s 4f 5d 6p |
| 87 Fr |
88 Ra |
89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
2×(1+3+5+7) = 32개 원소 7s 5f 6d 7p |
이것으로 현대 주기율표가 완성되었으며, 일곱 개의 행이 모두 완전히 채워져 있다.[80]
전자 배열표
[편집]다음 표는 각 원소의 중성 기체 상태 원자의 전자 배열을 보여준다. 서로 다른 화학 환경에서는 서로 다른 배열이 선호될 수 있다.[53] 주족 원소는 완전히 규칙적인 전자 배열을 가지는 반면, 전이 원소와 내부 전이 원소는 에너지 수준이 비슷한 부껍질이 서로 경쟁하면서 최대 20가지 불규칙성을 보인다. 마지막 10개 원소(109~118)의 경우 실험 데이터가 부족하므로[81] 이론적으로 계산된 배열이 대신 표시되었다.[82] 완전히 채워진 부껍질은 회색으로 표시되어 있다.
| 족: | 1 | 2 | | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1s: | 1 H 1 |
2 He 2 | ||||||||||||||||||||||||||||||
| [He] 2s: 2p: |
3 Li 1 - |
4 Be 2 - |
5 B 2 1 |
6 C 2 2 |
7 N 2 3 |
8 O 2 4 |
9 F 2 5 |
10 Ne 2 6 | ||||||||||||||||||||||||
| [Ne] 3s: 3p: |
11 Na 1 - |
12 Mg 2 - |
13 Al 2 1 |
14 Si 2 2 |
15 P 2 3 |
16 S 2 4 |
17 Cl 2 5 |
18 Ar 2 6 | ||||||||||||||||||||||||
| [Ar] 4s: 3d: 4p: |
19 K 1 - - |
20 Ca 2 - - |
21 Sc 2 1 - |
22 Ti 2 2 - |
23 V 2 3 - |
24 Cr 1 5 - |
25 Mn 2 5 - |
26 Fe 2 6 - |
27 Co 2 7 - |
28 Ni 2 8 - |
29 Cu 1 10 - |
30 Zn 2 10 - |
31 Ga 2 10 1 |
32 Ge 2 10 2 |
33 As 2 10 3 |
34 Se 2 10 4 |
35 Br 2 10 5 |
36 Kr 2 10 6 | ||||||||||||||
| [Kr] 5s: 4d: 5p: |
37 Rb 1 - - |
38 Sr 2 - - |
39 Y 2 1 - |
40 Zr 2 2 - |
41 Nb 1 4 - |
42 Mo 1 5 - |
43 Tc 2 5 - |
44 Ru 1 7 - |
45 Rh 1 8 - |
46 Pd - 10 - |
47 Ag 1 10 - |
48 Cd 2 10 - |
49 In 2 10 1 |
50 Sn 2 10 2 |
51 Sb 2 10 3 |
52 Te 2 10 4 |
53 I 2 10 5 |
54 Xe 2 10 6 | ||||||||||||||
| [Xe] 6s: 4f: 5d: 6p: |
55 Cs 1 - - - |
56 Ba 2 - - - |
57 La 2 - 1 - |
58 Ce 2 1 1 - |
59 Pr 2 3 - - |
60 Nd 2 4 - - |
61 Pm 2 5 - - |
62 Sm 2 6 - - |
63 Eu 2 7 - - |
64 Gd 2 7 1 - |
65 Tb 2 9 - - |
66 Dy 2 10 - - |
67 Ho 2 11 - - |
68 Er 2 12 - - |
69 Tm 2 13 - - |
70 Yb 2 14 - - |
71 Lu 2 14 1 - |
72 Hf 2 14 2 - |
73 Ta 2 14 3 - |
74 W 2 14 4 - |
75 Re 2 14 5 - |
76 Os 2 14 6 - |
77 Ir 2 14 7 - |
78 Pt 1 14 9 - |
79 Au 1 14 10 - |
80 Hg 2 14 10 - |
81 Tl 2 14 10 1 |
82 Pb 2 14 10 2 |
83 Bi 2 14 10 3 |
84 Po 2 14 10 4 |
85 At 2 14 10 5 |
86 Rn 2 14 10 6 |
| [Rn] 7s: 5f: 6d: 7p: |
87 Fr 1 - - - |
88 Ra 2 - - - |
89 Ac 2 - 1 - |
90 Th 2 - 2 - |
91 Pa 2 2 1 - |
92 U 2 3 1 - |
93 Np 2 4 1 - |
94 Pu 2 6 - - |
95 Am 2 7 - - |
96 Cm 2 7 1 - |
97 Bk 2 9 - - |
98 Cf 2 10 - - |
99 Es 2 11 - - |
100 Fm 2 12 - - |
101 Md 2 13 - - |
102 No 2 14 - - |
103 Lr 2 14 - 1 |
104 Rf 2 14 2 - |
105 Db 2 14 3 - |
106 Sg 2 14 4 - |
107 Bh 2 14 5 - |
108 Hs 2 14 6 - |
109 Mt 2 14 7 - |
110 Ds 2 14 8 - |
111 Rg 2 14 9 - |
112 Cn 2 14 10 - |
113 Nh 2 14 10 1 |
114 Fl 2 14 10 2 |
115 Mc 2 14 10 3 |
116 Lv 2 14 10 4 |
117 Ts 2 14 10 5 |
118 Og 2 14 10 6 |
|
| ||||||||||||||||||||||||||||||||
원소 위치 논쟁
[편집]1주기
[편집]오늘날 현대 주기율표가 표준으로 사용되지만, 1주기 원소인 수소와 헬륨의 배치는 여전히 논의 중인 미해결 문제이며 일부 변형 형태를 찾을 수 있다.[58][83] 각각 s1 및 s2 전자 배열에 따라, 수소는 1족에 배치되고 헬륨은 2족에 배치해야 한다.[58] 수소를 1족에 배치하는 것은 일반적이지만, 헬륨은 거의 항상 다른 비활성 기체와 함께 18족에 배치된다.[7] 이 논쟁은 화학적 또는 전자적 특성이 주기율표 배치에 얼마나 영향을 미쳐야 하는지에 대한 서로 상충하는 이해와 관련이 있다.[83]
1족 금속처럼 수소는 가장 바깥 껍질에 전자 하나를 가지고 있으며[84] 일반적으로 화학 반응에서 유일한 하나의 전자를 잃는다.[85] 수소는 일부 금속을 염에서 대체할 수 있는 일부 금속과 유사한 화학적 특성을 가지고 있다.[85] 하지만 반응성이 높은 고체 금속인 알칼리 금속과는 달리 표준 조건에서 이원자 비금속 기체를 형성한다. 이 특성과 수소가 전자를 얻는 수소화물을 형성하는 것은 같은 작용을 하는 할로젠의 특성과 가깝다[85] (비록 수소가 H+보다 H−를 형성하는 것이 더 드물지만).[86] 더욱이, 가장 가벼운 두 할로젠(플루오린과 염소)은 표준 조건에서 수소처럼 기체 상태이다.[85] 수소의 일부 특성은 어느 족에도 잘 맞지 않는다. 수소는 강력한 산화제도 강력한 환원제도 아니며 물과 반응하지 않는다.[86] 따라서 수소는 알칼리 금속과 할로젠의 특성을 모두 가지고 있지만, 어느 족에도 완벽하게 일치하지 않으므로 화학적 특성으로 명확하게 분류하기 어렵다.[85] 따라서 수소를 전자에 대한 특성을 보고 1족에 배치하는 것이 보통이지만, 일부 드문 배열로 수소를 17족에 배치하거나,[87] 수소를 1족과 17족에 중복 배치하거나,[88][89] 모든 족과 별도로 띄워 놓는 경우도 있다.[89][90][58] 그럼에도 불구하고 마지막 배치의 경우 화학자이자 과학철학자인 에릭 스케리가 수소가 다른 모든 원소와 달리 주기율 전체를 초월한다는 것을 암시하는 것처럼 보인다는 이유로 비판받았다.[91]
헬륨은 주기율표에서 전자 구조와 일치하지 않는 위치를 보편적으로 차지하는 유일한 원소이다. 헬륨은 가장 바깥 껍질에 전자 2개를 가지고 있는 반면, 다른 비활성 기체는 8개를 가지고 있다. 또한 헬륨은 S-구역 원소인 반면, 다른 모든 비활성 기체는 P-구역 원소이다. 그러나 헬륨은 표준 조건에서 비활성이고, 완전히 전자가 채워진 외부 껍질을 가지고 있다. 이러한 특성은 18족 비활성 기체와 같지만, 2족의 반응성이 높은 알칼리 토금속과는 전혀 다르다. 이러한 이유로 헬륨은 특성이 가장 잘 일치하는 18족에 거의 보편적으로 배치된다.[7][58] 또한 이런 이유로 헬륨을 2족으로 옮기자는 제안은 1988년에 국제 순수·응용 화학 연합(IUPAC)에서 거부되었다.[24] 그럼에도 불구하고 헬륨은 오늘날에도 여전히 2족에 가끔 배치되며,[92] 헬륨의 일부 물리적 및 화학적 특성은 2족 원소와 더 가깝고 전자적 배치도 이에 가깝다.[84][58] 고체 헬륨은 육방 밀집 구조로 결정화되며, 이는 2족의 베릴륨 및 마그네슘과 일치하지만 18족의 다른 비활성 기체와는 일치하지 않는다.[93] 최근 비활성 기체 화학의 이론적 발전(헬륨이 네온보다 약간 덜 비활성이며 아날로그 유사체 화합물과 유사한 구조를 가진 (HeO)(LiF)2를 형성할 것으로 예상되지만 네온 유사체는 예상되지 않음)으로 인해 더 많은 화학자가 헬륨을 2족에 배치할 것을 주장하고 있다. 이는 전자적 논증과 관련이 있는데, 네온의 더 큰 비활성 정도는 헬륨이 부족한 채워진 P-껍질로부터의 반발 때문이지만, 실제로는 헬륨 함유 분자가 극심한 저온 조건(약 10 K) 외에서는 안정하기 어렵다.[94][95][96][97]
주기율표의 1주기 원소의 이례적인 성질은 헬륨을 2족으로 옮기는 것을 지지하기 위해 추가적으로 인용되었다. 이는 어떤 유형의 첫 번째 궤도도 비정상적으로 작기 때문에 발생한다. 이는 더 높은 유사체와 달리 동일한 유형의 더 작은 궤도로부터의 전자 간 반발을 보이지 않기 때문이다. 이 때문에 각 구역의 첫 번째 원소는 비정상적으로 작으며, 이러한 원소는 해당 족에 대해 특성적인 종류의 이상 현상을 나타내는 경향이 있다. 헬륨의 위치 변경을 주장하는 일부 화학자는 헬륨이 2족에 배치될 경우 이러한 이상 현상을 나타내지만, 18족에 배치될 경우에는 나타내지 않는다고 지적했다. 반면에 헬륨이 18족에서 빠질 경우 첫 번째 18족 원소가 될 네온은 이러한 이상 현상을 나타낸다.[94] 헬륨과 베릴륨의 관계는 수소와 리튬의 관계와 유사하며, 이는 훨씬 더 일반적으로 받아들여지는 배치이다.[95] 예를 들어, 궤도 크기의 이러한 경향 때문에 각 주족의 첫 번째와 두 번째 원소 사이의 원자 반지름에 큰 차이가 1족과 13~17족에서 나타난다. 이는 네온과 아르곤 사이, 헬륨과 베릴륨 사이에 존재하지만, 헬륨과 네온 사이에는 존재하지 않는다. 이는 비활성 기체의 끓는점과 물에 대한 용해도에도 유사하게 영향을 미치는데, 헬륨은 네온과 너무 가깝고, 족의 첫 두 원소 사이의 특징적인 큰 차이는 네온과 아르곤 사이에서만 나타난다. 헬륨을 2족으로 옮기면 헬륨이 첫 번째 2족 원소가 되고 네온이 첫 번째 18족 원소가 됨으로써 2족과 18족에서도 이 경향이 일관되게 된다. 둘 다 카이노시메트릭한 족의 첫 번째 원소의 특징적인 특성을 나타낸다.[98][99] 그럼에도 불구하고 헬륨의 극단적인 비활성 정도 때문에 18족 배치가 거의 보편적으로 유지된다.[100] 또한 수소와 헬륨을 모두 모든 족 밖에 띄워 놓는 표도 드물게 볼 수 있다.[90][58][59]
3족
[편집]많은 주기율표에서 F-구역은 한 원소만큼 오른쪽으로 이동하여 란타넘과 악티늄이 3족의 D-구역 원소가 되고, 세륨-루테튬과 토륨-로렌슘이 F-구역을 이룬다. 따라서 D-구역은 매우 불균형한 두 부분으로 나뉜다. 이는 초기 전자 배열 측정의 실수에서 비롯된 잔재이다. 현대에 와서 측정 결과 3족에 루테튬과 로렌슘을 포함하고, 란타넘-이터븀과 악티늄-노벨륨을 F-구역으로 하는 형태가 더 일관적이다.[26][101]
4f 껍질은 이터븀에서 완전히 채워지며, 이러한 이유로 레프 란다우와 예브게니 리프시츠는 1948년에 루테튬을 F-구역 원소로 분류하는 것이 잘못되었다고 생각했다.[27] 그들은 아직 란타넘을 D-구역에서 제거하는 단계까지 나아가지는 않았지만, 곤도 준은 1963년에 란타넘의 저온 초전도 현상이 4f 껍질의 활성화를 의미한다는 것을 깨달았다.[102] 1965년, 데이비드 C. 해밀턴은 이 관찰을 주기율표에서의 위치와 연결시키고, F-구역이 란타넘-이터븀과 악티늄-노벨륨 원소들로 구성되어야 한다고 주장했다.[65] 그 이후로 물리적, 화학적, 전자적 증거가 이 배치를 지지해 왔다.[26][24][101] 이 문제는 1982년에 윌리엄 B. 젠슨의 글로 널리 알려졌고,[26] 루테튬과 로렌슘을 3족으로 재배치하는 것은 1988년(1-18족 번호가 권고되었을 때)[24]과 2021년 IUPAC 보고서에서 지지되었다.[25] 그럼에도 불구하고 여러 변형은 여전히 존재하는데, 이는 대부분의 교과서 저자들이 이 문제를 알지 못하기 때문이다.[26]
세 번째 형태는 때때로 3족의 이트륨 아래 공간을 비워두는 경우가 있는데, IUPAC 웹사이트에 나타난 표가 그러하다.[7] 그러나 이는 양자 역학과의 불일치를 보이는데 F-구역을 15개 원소 너비(란타넘–루테튬 및 악티늄–로렌슘)로 만들면서도 F-부껍질에는 14개의 전자만 들어갈 수 있기 때문이다.[25] 더욱이, 문헌에는 어떤 원소가 3족에 포함되는지에 대한 혼란이 존재한다.[25][34][103][104][105] 2021년 IUPAC 보고서는 15개 원소 너비의 F-구역이 상대론적 양자역학의 특정 분야에서 초악티늄족 원소의 특성에 초점을 맞추는 일부 화학자에게 지지된다고 언급했지만, 해당 프로젝트의 의견은 그러한 관심 의존적 우려가 주기율표가 "일반 화학 및 과학계"에 어떻게 제시되어야 하는지에 영향을 미치지 않아야 한다는 것이었다.[25] 초악티늄족 원소에 초점을 맞추는 다른 저자는 "F-구역의 15번째 항목이 F-구역 삽입물의 위치를 나타내기 위해 비워둔 D-구역의 첫 번째 슬롯을 나타낸다"고 명확히 하여, 이 형태가 루테튬과 로렌슘(문제의 15번째 항목)을 여전히 3족의 D-구역 원소로 포함한다는 것을 암시한다.[106] 실제로 IUPAC 간행물이 표를 32개 열로 확장할 때, 그들은 이를 명확히 하고 루테튬과 로렌슘을 3족의 이트륨 아래에 배치한다.[107][108]
문헌에서 스칸듐-이트륨-란타넘-악티늄 배치를 지지하는 여러 주장들을 찾아볼 수 있지만,[109][110] 이들은 논리적으로 일관되지 않다는 비판을 받았다.[64][29][30] 예를 들어, 란타넘과 악티늄은 개별 기체 상태 원자로서 f-부껍질을 채우기 시작하지 않았기 때문에 f-구역 원소가 될 수 없다고 주장되었다.[111] 그러나 이는 F-구역 원소로 논쟁의 여지가 없는 토륨에도 해당되는 이야기이며,[25][26] 이 주장은 다른 쪽 끝의 문제를 간과한다. 즉, F-껍질은 이터븀과 노벨륨에서 채워지는 것이 스칸듐-이트륨-루테튬-로렌슘 형태와 일치하며, 스칸듐-이트륨-란타넘-악티늄 형태가 주장하는 루테튬과 로렌슘에서는 채워지지 않는다.[112] 이러한 예외적인 배열은 소수에 불과할 뿐만 아니라,[112] 어떠한 경우에도 다른 원소의 주기율표 배치와 관련하여 고려된 적이 없다. 기체 원자에서 D-껍질은 구리, 팔라듐, 금에서 채워지지만, 화학자들은 이러한 배열이 예외적이며 D-구역은 쌓음 원리에 따라 아연, 카드뮴, 수은에서 실제로 끝난다는 것을 보편적으로 받아들인다.[34] 배치와 관련된 중요한 사실은[39][67] 란타넘과 악티늄(토륨과 마찬가지로)은 화학 환경에서 점유할 수 있는 원자가 f 궤도를 가지고 있는 반면, 루테튬과 로렌슘은 그렇지 않다는 것이다.[59][113][76] 그들의 f-껍질은 원자핵에 존재하며, 화학 반응에 사용할 수 없다.[66][114] 따라서 이트륨과 란타넘의 관계는 같은 수의 원자가 전자를 가지지만 다른 종류의 원자가 궤도를 가지는 원소들(예: 크로뮴과 우라늄) 사이의 이차적인 관계에 불과하다. 반면 이트륨과 루테튬의 관계는 원자가 전자 수와 원자가 궤도 유형을 모두 공유하는 일차적인 관계이다.[59]
주기적 성질
[편집]화학 반응은 원자가 전자의 이동으로 일어나므로,[33] 유사한 외부 전자 배열을 가진 원소는 화학 반응도 유사하게 일어나고, 또한 유사한 비율의 원소를 포함하는 화합물을 형성한다고 예상할 수 있다.[115] 이러한 원소는 같은 족에 배치되므로, 족을 따라 내려갈수록 화학적 행동에 명확한 유사성과 경향이 나타나는 경향이 있다.[116] 유사한 배열이 규칙적인 간격으로 나타나기 때문에 원소의 특성은 주기적으로 반복된다. 이것이 주기율표와 주기율의 이름의 유래이다. 이러한 주기적 반복은 이를 설명하는 기본 이론이 개발되기 훨씬 전에 발견되었다.[117][118]
원자 반지름
[편집]역사적으로 원자의 물리적 크기는 20세기 초까지 알려지지 않았다. 수소의 원자 반지름를 처음으로 계산한 추정치는 1910년 물리학자 아서 하스가 발표했으며, 이는 현재 알려진 값인 보어 반지름 (~0.529 Å)의 한 자릿수(10배) 이내였다. 하스는 반지름을 게산할 때 1904년 조지프 존 톰슨이 제안한 고전적 원자 모델인 '푸딩 모형'에 기반한 단일 전자 배열을 사용했다.[119]
원자 반지름은 최외각 궤도의 크기에 따라 달라진다.[98] 일반적으로 주족 원소를 따라 왼쪽에서 오른쪽으로 갈수록 핵전하가 증가하지만 외부 전자가 여전히 같은 껍질에 있으므로 반지름은 감소한다. 그러나 족을 따라 아래로 내려갈수록 최외각 전자가 더 높은 껍질에 있어 핵에서 멀어지기 때문에 반지름은 일반적으로 증가한다.[33][120] 각 구역의 첫 번째 줄은 카이노시메트리 또는 원초적 반발이라는 효과 때문에 비정상적으로 작다.[121] 1s, 2p, 3d, 4f 부껍질은 내부 이소체가 없다. 예를 들어, 2p 궤도는 1s 및 2s 궤도와는 각도 전하 분포가 상당히 다르므로 강한 반발을 경험하지 않아 그리 크지 않다. 그러나 3p 궤도는 유사한 각도 전하 분포를 가지는 2p 궤도에서 강한 반발을 경험한다. 따라서 더 높은 s-, p-, d-, f-부껍질은 거의 같은 각도 전하 분포를 가지는 내부 이소체로부터 강한 반발을 가지며 이를 피하기 위해 더 커져야 한다. 이 때문에 다중 결합을 선호하는 작은 2p 원소와 그렇지 않은 더 큰 3p 및 더 높은 p-원소 사이에 상당한 차이가 발생한다.[98] 유사한 이상 현상은 1s, 2p, 3d, 4f, 그리고 가설적인 5g 원소에서도 발생한다.[122] 이 1주기 원소의 이례적인 성질은 s-구역에서 가장 높고, p-구역에서는 중간 정도이며, d-구역과 f-구역에서는 덜 두드러진다.[123]
전이 원소에서는 내부 껍질이 채워지고 있지만, 원자의 크기는 여전히 외부 전자에 따라 결정된다. 계열을 따라 증가하는 핵전하와 차폐를 위한 증가된 내부 전자 수는 어느 정도 서로 상쇄되므로, 반지름의 감소는 더 작다.[120] 새로운 유형의 전이 계열이 처음 시작된 직후인 4p 및 5d 원자들은 예상보다 작다.[124] 이는 추가된 안쪽 3d 및 4f 부껍질이 외부 전자에 대한 핵전하를 불완전하게만 차폐하기 때문이다. 따라서 예를 들어 갈륨 원자는 알루미늄 원자보다 약간 작다.[98] 카이노시메트리와 함께, 이는 주기 사이에 짝수-홀수 차이(s-구역을 제외하고)[k]를 초래하며, 이는 때때로 2차 주기성으로 알려져 있다. 짝수 주기의 원소는 원자 반지름이 더 작고 더 적은 전자를 잃는 경향이 있으며, 홀수 주기의 원소들(첫 번째 주기를 제외하고)은 반대 방향으로 다르다. 따라서 예를 들어 p-구역의 많은 특성은 족을 따라 부드럽게 움직이기보다는 지그재그 형태를 보인다. 예를 들어, 15족의 홀수 주기에 있는 인과 안티모니는 +5 산화 상태에 쉽게 도달하는 반면, 짝수 주기에 있는 질소, 비소, 비스무트는 +3에 머무르는 것을 선호한다.[123][125] 비슷한 상황이 D-구역에도 적용되어, 루테튬에서 텅스텐 원자들은 각각 이트륨에서 몰리브데넘 원자보다 약간 작다.[126][127]

탈륨과 납 원자는 각각 인듐과 주석 원자와 거의 같은 크기이지만, 비스무트에서 라돈까지의 6p 원자는 동소체인 5p 원자보다 크다. 이는 원자핵이 매우 강하게 대전되면 전자 구름에 대한 핵의 효과를 측정하기 위해 특수 상대성이론이 필요하기 때문이다. 이러한 상대론적 효과는 무거운 원소가 주기율표에서 더 가벼운 동족체와 비교하여 점차 다른 특성을 가지게 되는 결과를 낳는다. 스핀-궤도 상호작용은 p 부껍질을 분리시킨다. 하나의 p 궤도는 상대론적으로 안정화되고 축소되지만(탈륨과 납에서 채워짐), 다른 두 개(비스무트에서 라돈까지 채워짐)는 상대론적으로 불안정화되고 확장된다.[98] 또한 상대론적 효과는 금이 금색을 띠고 수은이 실온에서 액체인 이유를 설명한다.[128][129] 이러한 효과는 7주기 후반에 매우 강해져 주기성을 붕괴시킬 가능성이 있다.[130] 전자 배열은 108번 원소(하슘)까지 명확하게 알려져 있으며, 108번 이후의 실험 화학은 112번 원소(코페르니슘)에서 115번 원소(모스코븀)까지만 이루어졌으므로, 가장 무거운 원소의 화학적 특성 규명은 현재 연구 주제로 남아 있다.[131][132]
원자 반지름이 왼쪽에서 오른쪽으로 갈수록 감소하는 경향은 이온 반지름에서도 나타나지만, 연속적인 원소의 가장 일반적인 이온은 전하가 다르기 때문에 조사하기가 더 어렵다. 같은 전자 배열을 가진 이온은 원자 번호가 증가함에 따라 크기가 감소하는데, 이는 양전하를 띠는 핵으로부터의 인력이 증가하기 때문이다. 따라서 예를 들어 Se2−, Br−, Rb+, Sr2+, Y3+, Zr4+, Nb5+, Mo6+, Tc7+ 계열에서 이온 반지름은 감소한다. 같은 원소의 이온은 더 많은 전자가 제거될수록 작아지는데, 이는 핵으로부터의 인력이 전자 구름을 팽창시키는 전자들 사이의 반발력을 능가하기 시작하기 때문이다. 따라서 V2+, V3+, V4+, V5+ 계열에서 이온 반지름은 감소한다.[133]
이온화 에너지
[편집]
원자의 1차 이온화 에너지는 원자에서 전자 1개를 제거하는 데 필요한 에너지이다. 이는 원자 반지름에 따라 달라진다. 이온화 에너지는 왼쪽에서 오른쪽으로, 아래에서 위로 갈수록 증가하는데, 이는 핵에 가까운 전자일수록 더 강하게 결합되어 제거하기가 더 어렵기 때문이다. 따라서 이온화 에너지는 각 주기의 첫 번째 원소인 수소와 알칼리 금속에서 가장 작으며, 그 후 일반적으로 주기의 오른쪽 끝에 있는 비활성 기체에 가까이 갈수록 증가한다.[33] 이러한 경향에는 산소와 같은 일부 예외가 있는데, 제거되는 전자가 쌍을 이루고 있어 전자 간 반발로 인해 예상보다 제거하기 쉽다.[134]
전이 계열에서는 내부 궤도가 채워지고 있음에도 불구하고 외부 전자가 우선적으로 빠진다. 예를 들어, 3d 계열에서는 3d 궤도가 채워지고 있음에도 4s 전자가 먼저 빠진다. 3d 전자를 추가될 때 발생하는 차폐 효과는 핵 전하 증가를 대략적으로 상쇄하므로, 이온화 에너지는 거의 일정하게 유지되지만 각 전이 계열의 끝에서는 특히 약간 증가한다.[135]
금속 원자는 화학 반응에서 전자를 잃는 경향이 있으므로, 이온화 에너지는 일반적으로 화학 반응성과 관련이 있지만 그 외 다른 요인들도 관여한다.[135]
전자 친화도
[편집]
이온화 에너지의 반대 특성은 전자 친화도인데, 이는 원자에 전자를 추가할 때 방출되는 에너지이다.[136] 전자가 핵의 인력을 더 강하게 느낄수록, 특히 수용할 수 있는 부분적으로 채워진 외부 궤도가 있을수록 원자에 더 쉽게 끌릴 것이다. 따라서 전자 친화도는 아래에서 위로, 왼쪽에서 오른쪽으로 갈수록 증가하는 경향이 있다. 예외는 마지막 열인 비활성 기체인데, 이들은 완전한 껍질을 가지고 있어 다른 전자를 채울 수 있는 공간이 없다. 이 때문에 그 왼쪽 열의 할로젠이 가장 높은 전자 친화도를 가지고 있다.[33]
일부 원자는 비활성 기체처럼 전자 친화도가 없다. 이들은 안정적인 기체상 음이온을 형성할 수 없다.[137] (입사 전자가 충분한 운동 에너지를 가지고 도착하면 준안정 공명을 형성할 수 있지만, 이들은 필연적으로 빠르게 자가이온화된다. 예를 들어, 가장 오래 지속되는 He− 준위의 수명은 약 359 마이크로초이다.)[138] 비활성 기체는 높은 이온화 에너지를 가지고 있고 전자 친화도가 없어 전자를 얻거나 잃으려는 경향이 거의 없으며 일반적으로 비활성이다.[33]
몇몇 예외적인 경향이 나타난다. 산소와 플루오린은 황과 염소보다 전자 친화도가 낮은데, 이는 원자가 작아서 새로 추가된 전자가 이미 존재하는 전자들로부터 상당한 반발이 있기 때문이다. 비금속 원소의 경우에도 전자 친화도는 반응성과 다소 상관관계가 있지만, 다른 요인이 관여하므로 완벽하지는 않다. 예를 들어, 플루오린은 염소보다 전자 친화도가 낮지만(매우 작은 플루오린 원자의 극심한 전자 간 반발 때문), 반응성은 더 높다.[136]
원자가와 산화 상태
[편집]원소의 원자가는 해당 원소가 결합하여 단순한 이원자 수소화물을 형성할 수 있는 수소 원자의 수, 또는 해당 원소가 결합하여 단순한 이원자 산화물(즉, 과산화물 또는 초과산화물이 아닌)을 형성할 수 있는 산소 원자 수의 두 배로 정의할 수 있다.[112] 주족 원소의 원자가는 족 번호와 직접적으로 관련되어 있다. 주족 1~2족 및 13~17족의 수소화물은 MH, MH2, MH3, MH4, MH3, MH2, 그리고 마지막으로 MH의 공식을 따른다. 최고 산화물은 대신 원자가가 증가하며, M2O, MO, M2O3, MO2, M2O5, MO3, M2O7의 공식을 따른다.[l] 오늘날 원자가의 개념은 산화수로 확장되었는데, 이는 화합물 내의 다른 모든 원소가 이온으로 제거되었을 때 원소에 남아 있는 형식적 전하이다.[115]
전자 배열을 통해 원자가는 결합에 사용할 수 있는 전자의 수로 설명할 수 있다.[115] 실제로 원자가 전자의 수는 1족에서 1개로 시작하여 주기율표의 오른쪽으로 갈수록 증가하며, 각 새로운 구역이 시작될 때마다 3개로 다시 설정된다. 따라서 6주기에서 세슘-바륨은 1-2개의 원자가 전자를 가지며, 란타넘-이터븀은 3-16개, 루테튬-수은은 3-12개, 탈륨-라돈은 3-8개를 가진다.[114] 그러나 D-구역과 F-구역의 오른쪽으로 갈수록 모든 원자가 전자를 사용하는 것에 해당하는 이론적 최대치는 전혀 달성할 수 없다.[139] 같은 상황이 산소, 플루오린, 그리고 크립톤까지의 가벼운 비활성 기체에도 영향을 미친다.[140]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H 1 |
He 2 | ||||||||||||||||||||||||||||||
| 2 | Li 1 |
Be 2 |
B 3 |
C 4 |
N 5 |
O 6 |
F 7 |
Ne 8 | ||||||||||||||||||||||||
| 3 | Na 1 |
Mg 2 |
Al 3 |
Si 4 |
P 5 |
S 6 |
Cl 7 |
Ar 8 | ||||||||||||||||||||||||
| 4 | K 1 |
Ca 2 |
Sc 3 |
Ti 4 |
V 5 |
Cr 6 |
Mn 7 |
Fe 8 |
Co 9 |
Ni 10 |
Cu 11 |
Zn 12 |
Ga 3 |
Ge 4 |
As 5 |
Se 6 |
Br 7 |
Kr 8 | ||||||||||||||
| 5 | Rb 1 |
Sr 2 |
Y 3 |
Zr 4 |
Nb 5 |
Mo 6 |
Tc 7 |
Ru 8 |
Rh 9 |
Pd 10 |
Ag 11 |
Cd 12 |
In 3 |
Sn 4 |
Sb 5 |
Te 6 |
I 7 |
Xe 8 | ||||||||||||||
| 6 | Cs 1 |
Ba 2 |
La 3 |
Ce 4 |
Pr 5 |
Nd 6 |
Pm 7 |
Sm 8 |
Eu 9 |
Gd 10 |
Tb 11 |
Dy 12 |
Ho 13 |
Er 14 |
Tm 15 |
Yb 16 |
Lu 3 |
Hf 4 |
Ta 5 |
W 6 |
Re 7 |
Os 8 |
Ir 9 |
Pt 10 |
Au 11 |
Hg 12 |
Tl 3 |
Pb 4 |
Bi 5 |
Po 6 |
At 7 |
Rn 8 |
| 7 | Fr 1 |
Ra 2 |
Ac 3 |
Th 4 |
Pa 5 |
U 6 |
Np 7 |
Pu 8 |
Am 9 |
Cm 10 |
Bk 11 |
Cf 12 |
Es 13 |
Fm 14 |
Md 15 |
No 16 |
Lr 3 |
Rf 4 |
Db 5 |
Sg 6 |
Bh 7 |
Hs 8 |
Mt 9 |
Ds 10 |
Rg 11 |
Cn 12 |
Nh 3 |
Fl 4 |
Mc 5 |
Lv 6 |
Ts 7 |
Og 8 |
완전한 설명은 단순히 전자 배열만을 고려하는 것이 아니라, 다른 원자가로 화합물을 형성할 때 방출될 에너지까지 고려해야 한다.[141] 예를 들어, 마그네슘은 물에 용해될 때 Mg+ 양이온보다 Mg2+ 양이온을 형성하는데, 이는 Mg+가 자발적으로 Mg0와 Mg2+ 양이온으로 불균등화되기 때문이다. 이는 수화 엔탈피(양이온을 물 분자로 둘러싸는 것)가 이온의 전하와 반지름에 따라 크기가 증가하기 때문이다. Mg+에서는 최외각 궤도(이온 반지름을 결정하는)가 여전히 3s이므로 수화 엔탈피가 작아 전자를 제거하는 데 필요한 에너지를 보상하기에 불충분하다. 그러나 Mg2+로 다시 이온화하면 내부의 2p 부껍질이 노출되어 수화 엔탈피가 마그네슘(II) 화합물 형성을 가능하게 할 만큼 충분히 커진다. 비슷한 이유로, 무거운 P-구역 원소(ns 전자가 np보다 에너지가 낮아지는 곳)의 일반적인 산화 상태는 2단계씩 변하는 경향이 있는데, 이는 내부 부껍질을 노출시키고 이온 반지름을 줄이는 데 필요하기 때문이다(예: Tl+는 6s를 노출하고, Tl3+는 5d를 노출하므로, 탈륨이 두 개의 전자를 잃으면 세 번째 전자도 잃는 경향이 있다). 궤도 혼성에 기반한 유사한 논증은 전기 음성도가 낮은 P-구역 원소에도 적용될 수 있다.[142][m]

전이 금속의 경우, 일반적인 산화 상태는 거의 항상 최소 +2이다(다음 부껍질을 노출하기 위한 비슷한 이유로). 이는 dx+1s1 또는 dx+2s0 배열을 가지는 예외적인 금속(은)에도 해당되는데, 이는 d-전자 사이의 반발이 두 번째 전자가 s-에서 d-부껍질로 이동하는 것이 이온화 에너지를 크게 바꾸지 않기 때문이다.[144] 전이 금속을 더 이온화해도 새로운 내부 부껍질이 노출되지 않기 때문에, 이들의 산화 상태는 1단계씩 변하는 경향이 있다.[142] 란타넘족과 악티늄족 끝쪽은 일반적으로 안정적인 +3 산화 상태를 보이며, 외부 s-전자를 제거한 후 (일반적으로) ns와 에너지가 유사한 (n-2)f 궤도에서 하나의 전자를 제거한다.[145] d-구역과 f-구역 원소의 일반적인 및 최대 산화 상태는 이온화 에너지에 따라 달라지는 경향이 있다. 각 전이 계열을 따라 (n-1)d와 ns 궤도 사이의 에너지 차이가 증가함에 따라, 더 많은 전자를 이온화하는 것이 에너지적으로 덜 유리해진다. 따라서 초기 전이 금속 족은 더 높은 산화 상태를 선호하는 경향이 있지만, +2 산화 상태는 후기 전이 금속 족에서 더 안정해진다. 따라서 최고 형식의 산화 상태는 각 d-구역 줄의 시작에서 +3에서 중간(예: OsO4)의 +7 또는 +8로 증가한 다음 끝에서 +2로 감소한다.[144] 란타넘족과 후기 악티늄족은 일반적으로 4차 이온화 에너지가 높으므로 +3 산화 상태를 거의 넘지 않는 반면, 악티늄족 앞쪽은 4차 이온화 에너지가 낮아서 예를 들어 넵투늄과 플루토늄은 +7까지 도달할 수 있다.[112][144][145] 가장 마지막 악티늄족은 란타넘족보다 낮은 산화 상태를 향해 더 나아간다. 멘델레븀은 툴륨이나 심지어 유로퓸(반쯤 채워진 f-껍질로 인해 +2 상태가 가장 안정적인 란타넘족 원소)보다 +2 상태로 환원되기 쉽고, 노벨륨은 이터븀과는 달리 +3보다 +2를 아예 선호한다.[55]
같은 족에 속하는 원소는 같은 원자가 배열을 공유하므로 일반적으로 유사한 화학적 행동을 보인다. 예를 들어, 1족의 알칼리 금속은 모두 원자가 전자 하나를 가지고 있으며, 매우 균질한 원소군을 형성한다. 이들은 모두 부드럽고 반응성이 높은 금속이다. 그러나 많은 요인들이 관여하며, 족은 종종 상당히 이질적일 수 있다. 예를 들어, 수소 또한 원자가 전자 하나를 가지고 있으며 알칼리 금속과 같은 족에 속하지만, 그 화학적 행동은 상당히 다르다. 14족의 안정적인 원소들은 비금속(탄소), 두 개의 반도체(규소와 저마늄), 그리고 두 개의 금속(주석과 납)으로 구성되어 있지만, 네 개의 원자가 전자를 가진다는 공통점으로 묶여 있다.[146] 이는 종종 최대 및 최소 산화 상태에서 유사성으로 이어진다(예: 황과 셀레늄은 16족에서 모두 SO3 및 SeO3와 같이 최대 산화 상태 +6을 가지며, 황화물 및 셀렌화물과 같이 최소 산화 상태 -2를 가진다). 그러나 항상 그렇지는 않다(예: 산소는 황과 셀레늄과 같은 족에 있음에도 불구하고 +6 산화 상태를 형성하는 것으로 알려져 있지 않다).[59]
전기 음성도
[편집]
원소의 또 다른 중요한 특성은 전기 음성도이다. 원자들은 전자 쌍을 공유하여 서로 공유 결합을 형성하고, 원자가 궤도가 서로 겹쳐진다. 각 원자가 공유 전자 쌍을 끌어당기는 정도는 원자의 전기 음성도에 따라 달라지며[147] 이는 원자가 전자를 얻거나 잃는 경향에 따라 달라진다.[33] 전기 음성도가 더 큰 원자는 전자 쌍을 더 많이 끌어당기는 경향이 있고, 전기 음성도가 더 작은(또는 전기 양성도가 더 큰) 원자는 덜 끌어당긴다. 극단적인 경우, 전자가 전기 양성도가 더 큰 원자에서 전기 음성도가 더 큰 원자로 완전히 이동했다고 생각할 수 있지만 이는 단순화한 모식이다. 이런 모습의 결합은 양이온(전자를 내어준)과 음이온(전자를 받아들인) 두 이온이 결합된 이온 결합이라고 한다.[33]
전기 음성도는 핵이 전자 쌍을 얼마나 강하게 끌어당기는지에 따라 달라지므로, 이미 논의된 다른 특성과 유사한 변화를 보인다. 전기 음성도는 위에서 아래로 갈수록 감소하고, 왼쪽에서 오른쪽으로 갈수록 증가하는 경향이 있다. 알칼리 및 알칼리 토금속은 가장 전기 양성적인 원소에 속하며, 16족 원소, 할로젠, 비활성 기체는 가장 전기 음성적인 원소에 속한다.[147]
전기 음성도는 일반적으로 폴링 척도로 측정된다. 이 척도에서 가장 전기 음성적인 원자(플루오린)는 4.0의 전기 음성도를 가지며, 가장 전기 음성도가 낮은 원자(세슘)는 0.79의 전기 음성도를 가진다.[33] 사실 네온이 가장 전기 음성적인 원소이지만, 폴링 척도로는 비활성 원자가 대부분의 원소와 공유 결합을 형성하지 않기 때문에 그 전기 음성도를 측정할 수 없다.[148]
원소의 전기 음성도는 결합된 원자의 종류와 수, 그리고 이미 잃은 전자의 수에 따라 달라진다. 원자는 더 많은 전자를 잃을수록 전기 음성도가 더 커진다.[147] 이는 때때로 큰 차이를 만들어낸다. +2 산화 상태의 납은 폴링 척도에서 전기 음성도 1.87을 가지는 반면, +4 산화 상태의 납은 전기 음성도 2.33을 가진다.[149]
금속성
[편집]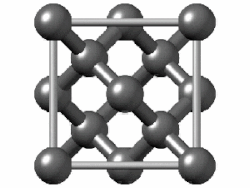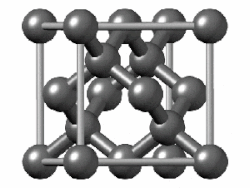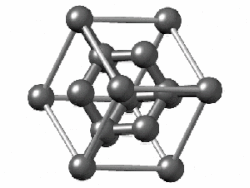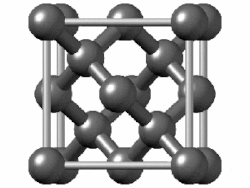
(회색 주석에서는 밴드 갭이 사라지고 금속성이 나타난다.[150] 주석에는 또 다른 동소체인 백주석이 있는데, 이 구조는 훨씬 더 금속성이 강하다.)
단물질은 하나의 화학 원자로 구성된 물질이다. 전기 음성도가 더 큰 원자의 단물질은 서로 전자를 공유(공유 결합 형성)하는 경향이 있다. 이들은 작거나 큰 분자(수소나 산소처럼 원자가 쌍을 이루어 결합하는 경우) 또는 무한히 확장되는 거대 구조(탄소나 규소처럼)를 형성한다. 비활성 기체는 이미 완전한 껍질을 가지고 있으므로 단순히 단원자로 존재한다.[33] 개별 분자 또는 단원자로 구성된 물질은 분자 간의 약한 인력(예: 런던 분산력)으로 함께 유지된다. 전자가 분자 내에서 움직일 때, 순간적인 전기적 불균형을 생성하며 이는 주변 분자에 유사한 불균형을 유도하고 많은 이웃 분자에서 전자의 동기화된 움직임을 생성한다.[151]

그러나 전기양성 원자는 대신 전자를 잃어 양이온을 둘러싸는 "전자 바다"를 생성하는 경향을 띈다.[33] 한 원자의 외부 궤도는 모든 이웃하는 원자와 전자를 공유하기 위해 겹쳐지며, 모든 원자에 걸쳐 확장되는 거대한 분자 궤도 구조를 형성한다.[152] 이 음전하를 띠는 "바다"는 모든 이온을 끌어당겨 금속 결합으로 함께 유지한다. 이러한 결합을 형성하는 원소를 종종 금속이라고 불리며, 그렇지 않은 원소는 종종 비금속이라고 불린다.[33] 일부 원소는 서로 다른 구조를 가진 여러 단물질을 형성할 수 있다. 이를 동소체라고 한다. 예를 들어, 다이아몬드와 흑연은 탄소의 두 동소체이다.[146][n]
원소의 금속성은 전자적 특성으로 예측할 수 있다. 원자 궤도가 금속 또는 공유 결합 중에 겹칠 때, 동등한 용량을 가진 결합 궤도와 반결합 궤도를 모두 생성하며 반결합 궤도는 더 높은 에너지를 가진다. 순수 결합 특성은 결합 궤도에 있는 전자가 반결합 궤도에 있는 전자보다 많을 때 발생한다. 따라서 금속 결합은 각 원자에 의해 비편재화된 전자의 수가 겹침에 기여하는 궤도 수의 두 배보다 적을 때 가능하다. 이는 1족부터 13족까지의 원소에 해당한다. 또한 모든 원자가 동등한 위치를 차지하는 거대한 공유 결합 구조를 형성하기에는 원자가 전자가 너무 적어서 거의 모두 금속화된다. 예외는 수소와 붕소인데, 이들은 이온화 에너지가 너무 높다. 따라서 수소는 공유 결합 H2 분자를 형성하고, 붕소는 이십면체 B12 클러스터를 기반으로 하는 거대한 공유 결합 구조를 형성한다. 금속에서는 결합 및 반결합 궤도가 겹치는 에너지를 가지므로, 전자가 자유롭게 흐를 수 있는 단일 띠를 형성하여 전기 전도를 가능하게 한다.[154]

14족에서는 금속 결합과 공유 결합이 모두 가능하다. 다이아몬드 결정에서 탄소 원자 간의 공유 결합은 강하다. 이는 원자 반지름이 작아서 핵이 전자를 더 강하게 붙들고 있기 때문이다. 따라서 결과적으로 형성되는 결합 궤도는 반결합 궤도보다 에너지가 훨씬 낮고 겹침이 없으므로 전기 전도가 불가능하다. 탄소는 비금속이다. 그러나 원자가 클수록 공유 결합이 약해지고 결합 및 반결합 궤도 사이의 에너지 간격이 줄어든다. 따라서 규소와 저마늄은 띠틈이 더 작고 상온 상압 조건에서 반도체이다. 전자는 열적으로 들뜨면 띠틈을 넘어설 수 있다. (붕소 또한 상온 상압 조건에서 반도체이다.) 띠틈은 주석에서 사라지므로 주석과 납은 금속이 된다.[154] 온도가 상승하면 모든 비금속은 띠틈의 크기에 따라 다소간 반도체 특성을 나타낸다. 따라서 금속과 비금속은 전기 전도도의 온도 의존성에 따라 구별할 수 있다. 금속의 전도도는 온도가 상승하면 감소하는 반면(열 운동이 전자의 자유로운 흐름을 더 어렵게 만들기 때문), 비금속의 전도도는 증가한다(더 많은 전자가 띠틈을 넘어설 수 있도록 들뜰 수 있기 때문).[155]
15족에서 17족까지의 원소는 너무 많은 전자를 가지고 있어서 삼차원적으로 확장되는 거대한 공유 결합 분자를 형성할 수 없다. 더 가벼운 원소의 경우, 작은 이원자 분자 내의 결합이 너무 강해서 응축상이 선호되지 않는다. 따라서 질소(N2), 산소(O2), 백린과 황비소(P4 및 As4), 황과 적셀레늄(S8 및 Se8), 그리고 안정적인 할로젠(F2, Cl2, Br2, I2)은 쉽게 원자 수가 적은 공유 결합 분자를 형성한다. 더 무거운 원소는 긴 사슬(예: 적린, 회색 셀레늄, 텔루륨) 또는 층상 구조(예: 흑연으로서의 탄소, 흑린, 회색 비소, 안티모니, 비스무트)를 형성하는 경향이 있는데, 이들은 삼차원이 아닌 한두 차원으로만 확장된다. 두 종류의 구조는 인, 비소, 셀레늄의 동소체에서 발견될 수 있지만, 긴 사슬 형태의 동소체가 세 가지 모두에서 더 안정적이다. 이러한 구조는 모든 궤도를 결합에 사용하지 않기 때문에 에너지 증가 순서로 결합, 비결합, 반결합 띠를 갖게 된다. 14족과 유사하게, 더 무거운 원소의 경우 띠틈이 줄어들고 사슬이나 층 사이에서 전자의 자유로운 이동이 가능해진다. 따라서 예를 들어 흑린, 흑비소, 회색 셀레늄, 텔루륨, 아이오딘은 반도체이고, 회색 비소, 안티모니, 비스무트는 반금속이며(매우 작은 띠 겹침으로 준금속적 전도도를 나타냄), 폴로늄과 아마도 아스타틴은 진정한 금속이다.[154] 마지막으로, 자연적인 18족 원소들은 모두 개별 원자로 존재한다.[154][o]
금속과 비금속의 구분선은 대략 왼쪽 위에서 오른쪽 아래로 대각선을 이룬다. 전이 계열은 이 대각선의 왼쪽에 나타나는데, 이는 겹침에 사용할 수 있는 궤도가 많기 때문이다. 이는 금속성이 전기양성도 및 전자를 잃으려는 경향과 상관관계가 있으며, 이는 오른쪽에서 왼쪽으로, 위에서 아래로 갈수록 증가하기 때문에 예상되는 결과이다. 따라서 금속의 수가 비금속의 수보다 훨씬 많다. 경계선 근처의 원소는 분류하기 어렵다. 이들은 금속과 비금속의 중간적인 특성을 가지는 경향이 있으며, 두 가지 모두의 특징적인 특성을 가질 수 있다. 이들은 종종 반금속 또는 준금속이라고 불린다.[33] 여기서 사용된 "반금속"이라는 용어는 띠 구조와 관련된 엄격한 물리적 의미와 혼동해서는 안 된다. 비스무트는 물리적으로 반금속이지만, 화학자들은 일반적으로 이를 금속으로 간주한다.[157]
다음 표는 표준 조건에서 가장 안정적인 동소체를 그렸다. 노란색으로 색칠된 원소는 금속 결합으로 잘 특성화된 단물질을 형성한다. 연한 파란색으로 색칠된 원소는 거대한 네트워크의 공유 결합 구조를 형성하며, 짙은 파란색으로 색칠된 원소는 더 약한 반데르발스 힘으로 결합된 작은 공유 결합 분자를 형성한다. 비활성 기체는 보라색으로 색칠되어 있다. 이 분자는 단일 원자이며 공유 결합이 발생하지 않는다. 회색으로 처리된 셀은 가장 안정적인 동소체가 이러한 방식으로 특성화될 만큼 충분한 양이 모이지 않은 원소들이다. 이론적 고려와 현재 실험적 증거는 이들 원소가 응축상을 형성할 수 있다면 모두 금속화될 것이라고 추정한다.[154] 오가네손은 예외일 수 있다.[158][p]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 족 → | ||||||||||||||||||||||||||||||||
| ↓ 주기 | ||||||||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
-
금속인 철
-
비금속인 황
-
준금속으로 불리는 원소인 비소
일반적으로 금속은 광택이 나고 밀도가 높다.[33] 금속 결합의 강도 때문에 녹는점과 끓는점이 높은 경향이 있으며, 원자가 금속 결합을 끊지 않고도 서로 움직일 수 있기 때문에 종종 가단성과 연성이 있다(쉽게 늘리고 자유롭게 모양을 만들 수 있다).[168] 전자가 삼차원 공간에서 자유롭게 움직일 수 있기 때문에 전기를 전도한다. 마찬가지로 열도 전도하는데, 이는 전자가 추가적인 운동 에너지로 전달되기 때문이다. 이들은 더 빠르게 움직인다. 이러한 특성은 액체 상태에서도 지속되는데, 이는 녹는 과정에서 결정 구조가 파괴되더라도 원자는 여전히 접촉하고 금속 결합이 약해지더라도 지속되기 때문이다.[168] 금속은 비금속에 대해 반응성이 높은 경향이 있다.[33] 이러한 일반화에 몇 가지 예외가 있다. 예를 들어 베릴륨, 크로뮴,[86] 망가니즈,[169] 안티모니,[170] 비스무트[171] 및 우라늄은 부서지기 쉽다(완전한 목록은 아님).[86] 크로뮴은 극도로 단단하다.[172] 갈륨, 루비듐, 세슘, 수은은 실온 또는 그 근처에서 액체이다.[q] 그리고 금과 같은 귀금속은 화학적으로 매우 불활성이다.[173][174]
비금속은 다른 특성을 보인다. 거대 공유 결정체를 형성하는 비금속은 높은 녹는점과 끓는점을 가지는데, 이는 강한 공유 결합을 극복하는 데 상당한 에너지가 필요하기 때문이다. 개별 분자를 형성하는 비금속은 주로 분산력을 통해 결합되어 있으며, 이는 더 쉽게 극복될 수 있다. 따라서 이들은 낮은 녹는점과 끓는점을 가지는 경향이 있으며,[175] 많은 경우 실온에서 액체 또는 기체이다.[33] 비금속은 종종 광택이 없게 보인다. 이들은 비활성 기체를 제외하고 금속과 반응성이 높은 경향이 있으며, 비활성 기체는 대부분의 물질에 대해 불활성이다.[33] 고체일 때는 원자들이 제자리에 단단히 고정되어 부서지기 쉽다. 밀도가 낮고 전기 전도성이 좋지 않은데,[33] 이는 이동 가능한 전자가 없기 때문이다.[176] 경계선 근처에서는 띠틈이 작으므로 해당 영역의 많은 원소들이 규소, 저마늄,[176] 텔루륨[154]과 같은 반도체이다. 셀레늄은 반도체인 회색 동소체와 절연체인 붉은 동소체를 모두 가지고 있으며, 비소는 금속성인 회색 동소체, 반도체인 검은 동소체, 절연체인 노란 동소체를 가지고 있다(단, 후자는 주변 조건에서 불안정하다).[155] 다시 예외가 있는데, 예를 들어 다이아몬드는 알려진 모든 재료 중에서 가장 높은 열전도율을 가지며, 어떤 금속보다도 높다.[177]
금속과 비금속 사이의 경계선을 가로지르는 준금속 부류를 지정하는 것이 일반적인데, 이는 해당 영역의 원소들이 물리적 및 화학적 특성 모두에서 중간적인 특성을 가지기 때문이다.[33] 그러나 정확히 어떤 원소들을 그렇게 지정해야 하는지에 대해서는 문헌에서 합의된 바가 없다. 이러한 분류가 사용될 때 규소, 저마늄, 비소, 텔루륨은 거의 항상 포함되며, 붕소와 안티모니는 보통 포함된다. 그러나 대부분의 자료는 추가할 다른 원소들에 대한 합의 없이 다른 원소들도 포함하며, 일부는 이 목록에서 제외하기도 한다.[r] 예를 들어, 일반적으로 준금속 또는 비금속으로 간주되는 다른 모든 원소와 달리, 안티모니의 유일하게 안정적인 형태는 금속 전도성을 가진다. 더욱이, 이 원소는 물리적 및 화학적 행동에서 비스무트, 그리고 더 일반적으로 다른 P-구역 금속과 유사하다. 이러한 근거로 일부 저자들은 안티모니를 준금속보다는 금속으로 분류하는 것이 더 적절하다고 주장했다.[86][182][155] 반면에 셀레늄은 가장 안정적인 형태에서 일부 반도체 특성을 가지며(단, 절연성 동소체도 있음) 준금속으로 간주되어야 한다고 주장하는 경우도 있다.[182] 그러나 이러한 상황은 인에도 적용되며,[155] 인은 준금속에 포함되는 경우는 거의 없다.[r]
주기성의 추가적인 발현
[편집]주기율표 전체에는 같은 족에 속하지 않는 원소들 사이에도 다른 관계가 존재한다. 예를 들어, 대각선으로 인접한 원소들(예: 리튬과 마그네슘) 사이의 대각선 관계가 있다.[123] 또한 주족과 전이 금속 족 사이, 또는 초기 악티늄족과 초기 전이 금속 사이에 유사성을 찾을 수 있는데, 이는 원소가 같은 수의 원자가 전자를 가질 때 나타난다. 따라서 우라늄은 6족의 크로뮴과 텅스텐과 다소 유사한데,[123] 이 세 원소 모두 6개의 원자가 전자를 가지기 때문이다.[183] 같은 수의 원자가 전자를 가지지만 다른 유형의 원자가 궤도를 가지는 원소 사이의 관계는 이차 또는 이소도너 관계라고 불린다. 이들은 일반적으로 최대 산화 상태는 같지만 최소 산화 상태는 다르다. 예를 들어, 염소와 망가니즈는 모두 +7을 최대 산화 상태로 가지지만(예: Cl2O7 및 Mn2O7), 각각의 최소 산화 상태는 -1(HCl)과 -3(K2[Mn(CO)4])이다. 같은 수의 원자가 빈 공간을 가지지만 다른 수의 원자가 전자를 가지는 원소는 삼차 또는 이소액셉터 관계로 이어진다. 이들은 일반적으로 최소 산화 상태는 유사하지만 최대 산화 상태는 다르다. 예를 들어, 수소와 염소는 모두 -1을 최소 산화 상태로 가지지만(수소화물 및 염화물에서), 수소의 최대 산화 상태는 +1(H2O)인 반면 염소는 +7이다.[59]
녹는점, 끓는점, 융해열, 기화열, 원자화 에너지 등 원소의 다른 많은 물리적 특성들도 주기율에 따라 주기적인 변화를 보인다. 유사한 주기적 변화는 원소의 화합물에서도 나타나며, 수소화물, 산화물, 황화물, 할로젠화물 등을 비교하여 관찰할 수 있다.[147] 화학적 특성은 정량적으로 설명하기 더 어렵지만, 마찬가지로 고유한 주기성을 보인다. 예시로는 원소 및 그 화합물의 산성 및 염기성 특성, 화합물의 안정성, 원소 분리 방법의 변화 등이 있다.[115] 주기성은 알려지지 않은 새로운 원소 및 새로운 화합물의 특성을 예측하는 데 매우 널리 사용되고 있으며, 현대 화학의 핵심이다.[184]
원소 분류
[편집]문헌에서 유사하게 행동하는 원소를 한 데 묶는 분류를 설명하는 데 많은 용어를 사용했다. 족 이름인 알칼리 금속, 알칼리 토금속, 13족 원소, 14족 원소, 15족 원소, 16족 원소, 할로젠, 비활성 기체는 IUPAC에서 인정하는 용어이다. 그 외 다른 족은 번호 또는 첫 번째 원소로 지칭할 수 있다(예: 6족은 크로뮴족이다).[23][185] 일부는 13족에서 16족까지의 P-구역 원소를 금속성으로 분류하지만,[180][178] 금속, 비금속 또는 반금속(때로는 준금속이라고도 함)으로 정확히 어떤 원소를 간주해야 하는지에 대한 IUPAC 정의나 정확한 합의는 없다.[180][178][23] 전이 금속 다음에 오는 금속을 무엇이라고 불러야 하는지에 대한 합의도 없으며, 전이후 금속과 악한 금속 등이 사용된 용어 중 하나이다. 일부 고급 단행본은 12족 원소를 때때로 상당히 다른 화학적 특성을 이유로 전이 금속에서 제외하지만, 이는 보편적인 관행이 아니며[186] IUPAC는 현재 화학 명명법 원칙에서 이를 허용한다고 언급하지 않는다.[187]
란타넘족은 란타넘~루테튬 사이 원소로 간주되며, 이들은 모두 서로 매우 유사하다. 역사적으로는 세륨~루테튬만 포함되었지만, 란타넘은 일반적인 사용으로 포함되었다.[23] 희토류 원소는 스칸듐과 이트륨을 란타넘족에 추가한 것이다.[23] 유사하게, 악티늄족은 악티늄~로렌슘 사이 원소로 간주된다(역사적으로는 토륨~로렌슘).[23] 비록 이 집합 내의 특성 변화는 란타넘족 내보다 훨씬 크지만 말이다.[53] IUPAC는 -화물 접미사가 일반적으로 음이온을 나타내므로 모호성을 피하기 위해 란타넘족 원소 및 악티늄족 원소라는 이름을 권장하지만, 란타넘족 및 악티늄족이라는 용어가 여전히 일반적으로 사용된다.[23] 루테튬과 로렌슘이 D-구역 원소로 점차 인식됨에 따라, 일부 저자는 란타넘족을 란타넘~이터븀으로, 악티늄족을 악티늄~노벨륨으로 정의하기 시작했으며 이는 F-구역 원소와 일치한다.[58][26][188][189][190][191] 트랜스악티늄족 원소 또는 초악티늄족 원소는 악티늄족 이후의 짧은 수명을 가진 원소로, 로렌슘 또는 러더포듐에서 시작된다(악티늄족이 끝나는 지점에 따라 다름).[191][192][193][194][195]
이 외에도 더 많은 분류가 존재하며 특정 분야에 따라 사용된다. 천체물리학에서 금속은 원자 번호가 2보다 큰 모든 원소, 즉 수소와 헬륨을 제외한 모든 것을 의미한다.[196] "반금속"이라는 용어는 화학에서와는 다른 물리적 정의를 갖는다. 비스무트는 물리적 정의에 따르면 반금속이지만, 화학자는 일반적으로 이를 금속으로 간주한다.[197] 몇몇 용어는 널리 사용되지만, "중금속"과 같이 매우 형식적인 정의 없이 사용되며, 너무 광범위하게 정의되어 "실질적으로 무의미하다"는 비판을 받기도 했다.[198]
용어의 범위는 저자마다 크게 다르다. 예를 들어, IUPAC에 따르면 비활성 기체는 매우 방사성인 초악티늄족 원소인 오가네손을 포함하여 전체 족을 포함한다.[199] 그러나 초악티늄족 원소 전문가 사이에서는 흔히 그렇지 않다. 이 경우 "비활성 기체"는 일반적으로 이 족의 더 가벼운 원소들의 비반응적 행동을 의미하는 것으로 해석된다. 계산상 오가네손은 상대론적 효과로 인해 특별히 비활성적이지 않을 것으로 예측되며, 대량 생산될 경우 실온에서 기체가 아닐 수도 있기 때문에 이러한 맥락에서 그 비활성 기체로서의 지위는 종종 의문시된다.[200] 더욱이, 국가별 차이가 때때로 발견된다. 일본에서는 알칼리 토금속이 종종 베릴륨과 마그네슘을 포함하지 않는데, 이는 그들의 행동이 더 무거운 2족 금속과 다르기 때문이다.[201]
역사
[편집]초기 역사
[편집]1817년, 독일 물리학자 요한 볼프강 되베라이너는 원소를 분류하려는 초기 시도로 원소를 공식화하기 시작했다.[202] 1829년 되베라이너는 일부 원소를 세 개씩 묶을 수 있으며, 각 묶음의 원소는 서로 비슷한 속성을 가진다는 것을 발견했다. 그는 이 묶음을 삼원소라고 불렀다.[203][204] 염소, 브로민, 아이오딘이 삼원소를 형성했으며, 칼슘, 스트론튬, 바륨도 그러했고, 리튬, 나트륨, 칼륨도 그러했으며, 황, 셀레늄, 텔루륨도 그러했다. 오늘날 이 모든 삼원소는 현대의 족(할로젠, 알칼리 토금속, 알칼리 금속, 칼코젠)의 일부를 이룬다.[205] 다양한 화학자가 그의 연구를 이어받아 더 많은 소규모 원소 무리 간의 관계를 확인할 수 있었다. 그러나 이 모든 것을 포함하는 하나의 체계를 구축하지는 못했다.[206]

존 뉴랜즈는 1863년 2월 《케미컬 뉴스》 지에 화학 원소의 주기성에 대한 논문을 발표했다.[207] 1864년 뉴랜즈는 《케미컬 뉴스》에 원소를 원자량 순서로 배열하면 연속적인 번호를 가진 원소가 종종 같은 족에 속하거나 다른 족에서 비슷한 위치를 차지한다는 사실을 보여주는 논문을 발표했다. 그는 주어진 원소부터 시작하여 여덟 번째 원소마다 음악의 8도처럼 첫 번째 원소의 일종의 반복이 나타난다고 지적했다(옥타브의 법칙).[207] 그러나 뉴랜즈의 공식화는 주로 전형 원소에 대해서만 잘 작동했고, 다른 원소에 대해서는 심각한 문제가 발생했다.[59]
독일 화학자 로타르 마이어는 비슷한 화학적 및 물리적 특성의 순서가 주기적인 간격으로 반복된다는 것을 주목했다. 그에 따르면, 원자량을 종축(즉, 수직)으로, 원자 부피를 횡축(즉, 수평)으로 정렬하면 그 선이 일련의 최대값과 최소값을 얻으며, 가장 전기 양성적인 원소는 원자량 순서대로 곡선의 정점에 나타날 것이다. 1864년에 그의 책이 출판되었는데, 이 책에는 28개의 원소를 포함하는 초기 주기율표가 있었고 원소를 원자가에 따라 6개의 계열로 분류했다. 이는 원소를 원자가에 따라 분류한 최초의 사례였다. 당시 원자량을 계산하고 구하는 작업은 부정확한 원자량 측정으로 인해 난관에 봉착했다.[208] 1868년에 그는 자신의 표를 수정했지만, 이 수정본은 그의 사후에 초고로만 출판되었다.[209]
멘델레예프의 표
[편집]결정적인 돌파구는 러시아 화학자 드미트리 멘델레예프가 이루어냈다. 마이어를 포함한 다른 화학자도 거의 동시에 주기율 체계의 다른 버전을 발견했지만, 멘델레예프는 자신의 체계를 개발하고 방어하는 데 가장 헌신적이었고, 그의 체계가 과학계에 가장 큰 영향을 미쳤다.[210] 1869년 2월 17일(그레고리력으로는 1869년 3월 1일), 멘델레예프는 원소를 배열하고 이를 원자량에 따라 비교하기 시작했다. 그는 몇몇 원소로 시작하여 하루 동안 그의 체계가 알려진 대부분의 원소를 포함할 정도로 확장되었다. 일관된 배열을 찾은 후, 멘델레예프의 인쇄된 표는 1869년 5월 러시아 화학 학회지에 실렸다.[211] 원소들가 이 체계에 맞지 않는 것처럼 보일 때는 과감하게 원자가 또는 원자량이 잘못 측정되었거나, 중간에 아직 발견되지 않은 누락된 원소가 있다고 예측했다.[59] 1871년 멘델레예프는 자신의 표의 업데이트된 형태를 포함하는 긴 논문을 발표했는데, 여기서 미지의 원소에 대한 예측을 명시적으로 밝혔다. 멘델레예프는 이 미지의 원소 중 세 가지 원소의 속성을 상세하게 예측했다. 이 원소는 각각 붕소, 알루미늄, 규소의 더 무거운 동족체가 될 것이므로, 그는 이들을 에카-붕소, 에카-알루미늄, 에카-규소("에카"는 산스크리트어로 "하나"를 의미함)라고 명명했다.[211][212]:45 1875년, 프랑스 화학자 폴에밀 르콕 드 부아보드랑은 멘델레예프의 예측을 알지 못한 채 섬아연석 광물 샘플에서 새로운 원소를 발견하고 갈륨이라고 명명했다. 그는 이 원소를 분리하고 그 특성을 분석하기 시작했다. 드 부아보드랑의 논문을 읽은 멘델레예프는 갈륨이 자신이 예측한 에카-알루미늄이라고 주장하는 편지를 보냈다. 처음에는 드 부아보드랑이 회의적이었고 멘델레예프가 자신의 발견에 대한 공로를 가로채려 한다고 의심했지만, 나중에 멘델레예프가 옳았음을 인정했다.[213] 1879년, 스웨덴 화학자 라르스 프레드리크 닐손은 스칸듐이라고 명명한 새로운 원소를 발견했는데, 이는 에카-붕소로 밝혀졌다. 에카-규소는 1886년 독일 화학자 클레멘스 빙클러가 발견하여 저마늄이라고 명명했다. 갈륨, 스칸듐, 저마늄의 특성은 멘델레예프가 예측한 것과 일치했다.[214] 1889년 멘델레예프는 런던 왕립 학회에서 열린 패러데이 강연에서 "이들의 발견을 대영 화학 학회에 주기율의 정확성과 보편성을 확인하는 것으로 언급할 만큼 (내가) 오래 살 것이라고는 예상하지 못했다"고 언급했다.[215] 19세기 말에 멘델레예프가 예측하지 못했던 비활성 기체의 발견조차도 그의 체계에 여덟 번째 주족으로 깔끔하게 들어맞았다.[216]
그럼에도 불구하고 멘델레예프는 알려진 란타넘족 원소를 그의 체계에 맞추는 데 어려움을 겪었다. 왜냐하면 이 원소는 다른 원소들처럼 원자가의 주기적 변화를 보이지 않았기 때문이다. 많은 연구 끝에 체코 화학자 보후슬라프 브라우너는 1902년에 란타넘족 원소를 모두 주기율표의 한 족에 함께 배치할 수 있다고 제안했다. 그는 이를 천문학적 유추로서 "소행성 가설"이라고 명명했다. 화성과 목성 사이에 단일 행성 대신 소행성대가 있는 것처럼, 이트륨 아래의 자리는 단일한 원소 대신 모든 란타넘족 원소로 채워져야 한다고 생각했다.[34]
원자 번호
[편집]
원자의 내부 구조가 탐구된 후, 네덜란드 아마추어 물리학자 안토니우스 반 덴 브록은 1913년에 원자핵의 전하가 주기율표에서 원소의 위치를 결정한다고 제안했다.[217][218] 뉴질랜드 물리학자 어니스트 러더포드는 이 원자핵 전하에 대해 "원자 번호"라는 용어를 만들었다.[219] 반 덴 브록의 출판된 논문에서 그는 원소가 전자 수에 따라 배열된 최초의 전자 주기율표를 그렸다.[220] 러더포드는 1914년 자신의 논문에서 보어가 반 덴 브록의 견해를 수용했음을 확인했다.[221]
같은 해, 영국의 물리학자 헨리 모즐리는 엑스선분광학을 사용하여 반 덴 브록의 제안을 실험적으로 확인했다. 모즐리는 알루미늄부터 금까지 각 원소의 핵 전하 값을 결정했으며, 멘델레예프의 배열이 실제로 원소를 원자핵의 전하 순서로 연속적으로 배치된다는 것을 보여주었다.[222] 원자핵 전하는 양성자 수와 동일하며 각 원소의 원자 번호(Z) 값을 결정한다. 원자 번호를 사용하면 원소에 대한 명확한 정수 순서를 얻을 수 있다. 모즐리의 연구는 원자량과 화학적 특성 사이의 불일치, 즉 원자 번호는 증가하지만 원자량은 감소하는 텔루륨과 아이오딘과 같은 경우의 문제를 곧바로 해결했다.[217] 모즐리는 곧 제1차 세계 대전에서 사망했지만, 스웨덴 물리학자 만네 시그반은 우라늄까지 그의 연구를 계속이어가 당시 알려진 가장 높은 원자 번호(92)를 가진 원소임을 입증했다.[223] 모즐리와 시그반의 연구를 바탕으로 아직 발견되지 않은 원소의 원자 번호(43, 61, 72, 75, 85, 87)도 알려지게 되었다.[217] (원소 75는 사실 1908년 일본 화학자 마사타카 오가와가 이미 발견하여 니포늄이라고 명명했지만, 그는 실수로 이 원소를 75번이 아닌 43번 원소라고 착각하여 그의 발견은 나중에야 학계에 인정되었다. 원소 75의 현재 인정되는 최초 발견은 1925년에 발터 노다크, 이다 타케, 오토 베르크가 독립적으로 재발견하여 현재 이름인 레늄을 부여했을 때 이루어졌다.)[224]
원자 물리학의 도래는 동위 원소의 상황을 명확히 했다. 원시 방사성 원소인 토륨과 우라늄의 붕괴 사슬에서, 곧이어 원자량은 다르지만 화학적 특성은 정확히 같은 많은 새로운 원소들이 나타난다는 것이 분명해졌다. 1913년에 프레더릭 소디는 이러한 상황을 설명하기 위해 "동위 원소"라는 용어를 만들었고, 동위 원소를 단순히 같은 화학 원소의 다른 형태라고 생각했다. 이는 또한 텔루륨과 아이오딘과 같은 불일치를 명확히 했다. 텔루륨의 자연 동위 원소 구성은 아이오딘보다 무거운 동위 원소 쪽으로 치우쳐 있지만, 텔루륨은 원자 번호가 더 낮다.[225]
전자 껍질
[편집]덴마크 물리학자 닐스 보어는 막스 플랑크의 양자화 개념을 원자에 적용했다. 이들은 전자의 에너지 준위가 양자화되어 있다고 결론내렸다. 즉 전자는 안정적인 에너지 상태가 띄엄띄엄 떨어진 이산적인 간격 사이세서만 움직일 수 있다. 보어는 1913년 내부 전자도 원소의 화학적 특성에 영향을 줄 것이라 추측하면서 전자 배열을 통해 원소의 주기성을 이해하려고 시도했다.[226][227] 1913년 보어는 양자화된 원자에 기반한 최초의 전자 주기율표를 만들었다.[228]
보어는 1913년에 자신의 전자 껍질을 "고리"(rings)라고 불렀다. 당시 그의 행성 모델에는 껍질 내 원자 궤도가 존재하지 않았다. 보어는 그의 유명한 1913년 논문 3부에서 껍질당 최대 전자가 8개라고 설명하며, "또한 우리는 n개의 전자로 이루어진 고리가 전하 ne를 가진 핵 주위를 하나의 고리에서 회전할 수 없다는 것을 알 수 있다. 단, n < 8인 경우를 제외한다."라고 썼다. 더 작은 원자의 경우 전자 껍질은 다음과 같이 채워진다. "전자 고리는 같은 수의 전자를 포함할 경우에만 결합할 것이며, 따라서 내부 고리의 전자 수는 2, 4, 8이 될 것이다." 그러나 원자번호가 더 큰 원자에서는 가장 안쪽 껍질이 8개의 전자를 포함할 것이다. "반면에, 원소 주기율표는 이미 네온 N = 10에서 8개의 전자로 이루어진 내부 고리가 나타날 것임을 강력히 시사한다."라고 말했다. 그가 제안한 원자들의 전자 배열(오른쪽에 표시됨)은 대부분 현재 알려진 것과 일치하지 않는다.[229][230] 이들은 아르놀트 조머펠트와 에드먼드 스토너가 더 많은 양자수를 발견하면서 개선되었다.[225]
| 원소 | 껍질당 전자 수 |
|---|---|
| 4 | 2,2 |
| 6 | 2,4 |
| 7 | 4,3 |
| 8 | 4,2,2 |
| 9 | 4,4,1 |
| 10 | 8,2 |
| 11 | 8,2,1 |
| 16 | 8,4,2,2 |
| 18 | 8,8,2 |
보어의 원자 이론의 화학적 전위를 체계적으로 확장하고 수정하려 한 최초의 인물은 1914년과 1916년의 발터 코셀이었다. 코셀은 주기율표에서 새로운 원소는 전자가 외부 껍질에 추가될 때 생성될 것이라고 설명했다. 코셀의 논문에서 그는 다음과 같이 썼다.
이는 추가되는 전자가 동심원의 고리 또는 껍질에 들어가야 하며, 각 고리에는 ... 특정 수의 전자, 즉 우리의 경우 8개만 배열되어야 한다는 결론으로 이어진다. 하나의 고리 또는 껍질이 완성되는 즉시, 다음 원소에서는 새로운 고리를 채우면서 시작해야 한다. 가장 쉽게 접근할 수 있고 가장 바깥쪽에 위치한 전자의 수는 원소마다 다시 증가하므로, 각 새로운 껍질의 형성에서 화학적 주기성이 반복된다.[231][232]
1919년 논문에서 어빙 랭뮤어는 현재 우리가 전자 궤도라고 부르는 "세포"의 존재를 가정했는데, 각 세포는 최대 8개의 전자를 가질 수 있으며, 이들은 현재 우리가 껍질이라고 부르는 "같은 거리를 둔 층"에 배열되어 있다. 그는 첫 번째 껍질만 2개의 전자를 포함하다는 예외를 두었다.[233] 화학자 찰스 루젤리 베리는 1921년에 껍질에 8개와 18개의 전자가 안정적인 배열을 형성한다고 제안했다. 베리는 전이 원소의 전자 배열이 바깥 껍질의 원자가 전자에 달려 있다고 주장했다.[234] 그는 현재 전이 금속 또는 전이 원소로 알려진 원소들을 설명하기 위해 처음으로 전이(transition)라는 단어를 도입했다.[235] 보어의 이론은 72번 원소의 발견으로 입증되었다. 조르주 위르뱅은 이를 희토류 원소인 셀튬으로 발견했다고 주장했지만, 베리와 보어는 72번 원소가 희토류 원소가 될 수 없으며 지르코늄의 동족체여야 한다고 예측했다. 디르크 코스터와 게오르크 폰 헤베시는 지르코늄 광석에서 그 원소를 찾아냈고, 그들은 보어의 고향인 코펜하겐(라틴어로 하프니아(Hafnia))의 이름을 따서 하프늄이라고 명명했다.[236][237] 위르뱅의 셀튬은 단순히 정제된 루테튬(원소 71)으로 밝혀졌다.[238] 따라서 하프늄과 레늄이 마지막으로 발견된 안정 원소가 되었다.[225]
보어의 이론을 받아 볼프강 파울리는 1923년 전자 배열 문제를 다루었다. 파울리는 보어의 체계를 4개의 양자수를 사용하도록 확장하고, 두 개의 전자가 같은 4개의 양자수를 가질 수 없다는 파울리 배타 원리를 공식화했다. 이는 주기율표에서 보이는 주기의 길이(2, 8, 18, 32)를 설명할 수 있는데 주기는 각 껍질이 차지할 수 있는 전자 수에 해당한다.[239] 1925년에 프리드리히 훈트는 현대의 배열과 유사한 배열에 도달했다.[240] 이러한 발전 끝에 주기성은 원소의 원자가보다는 화학적으로 활성인 또는 원자가 전자의 수에 기반하는 것으로 전환되었다.[59] 원소의 전자 배열을 설명하는 쌓음 원리는 1926년 에르빈 마델룽이 처음 경험적으로 관찰했지만,[46] 이를 처음 발표한 사람은 1930년 블라디미르 카라페토프였다.[241][242] 1961년, 프세볼로트 클레치콥스키는 토마스-페르미 모델에서 쌓음 원리의 첫 부분(궤도가 n + ℓ 증가 순서로 채워진다는 것)을 이론을 통해 도출했다.[243] 완전한 규칙은 1971년 유리 N. 뎀코프와 발렌틴 N. 오스트로프스키가 비슷한 퍼텐셜을 통해 도출되었다.[244][s]

양자 이론은 전이 금속과 란타넘족 원소가 주족 원소들 사이에 자신들만의 별개 집단을 형성함을 명확히 보였지만, 일부 화학자는 이미 그 전부터 별도로 표시하는 방식으로 전이 금속 계열을 보여주는 주기율표를 제안했다. 영국의 화학자 헨리 배싯은 1892년에, 덴마크의 화학자 율리우스 톰센은 1895년에, 스위스의 화학자 알프레트 베르너는 1905년에 이런 주기율표를 작성했다. 보어는 1922년 노벨 강연에서 톰센의 형태를 사용했으며, 베르너의 형태는 현대의 32열 형태와 매우 유사하다. 특히, 이는 브라우너의 소행성 가설을 대체했다.[34]
란타넘족의 정확한 위치와 그에 따른 3족의 구성은 수십 년간 논란의 여지가 있었는데, 그들의 전자 배열이 처음에는 잘못 측정되었기 때문이다.[26][94] 화학적 근거로 배싯, 베르너, 베리는 스칸듐과 이트륨을 란타넘이 아닌 루테튬과 함께 분류했다 (앞의 두 사람은 루테튬이 아직 발견되지 않았기 때문에 이트륨 아래에 빈 공간을 남겨두었다).[34][234] 훈트는 1927년에 모든 란타넘족 원자가 주로 3가라는 이유로 [Xe]4f0−145d16s2의 배열을 가진다고 가정했다. 현대에서는 화학과 전자 배열 사이의 관계가 그보다 더 복잡하다는 것이 알려져 있다.[t][245] 초기 분광학적 증거에선 이러한 배열을 확인하는 듯 보였고, 따라서 주기율표는 3족을 스칸듐, 이트륨, 란타넘, 악티늄으로 구성하고, 란타넘과 하프늄 사이에 14개의 f-원소를 넣어 d-구역을 분할하도록 구성되었다.[26] 그러나 나중에 이것이 15개의 란타넘족 원소 중 4개(란타넘, 세륨, 가돌리늄, 루테튬)에만 해당되며, 다른 란타넘족 원자는 d-전자를 가지지 않는다는 것이 밝혀졌다. 특히 이터븀은 4f 껍질을 완성하며, 따라서 1948년 소련의 물리학자 레프 란다우와 예브게니 리프시츠는 루테튬이 f-구역 원소가 아닌 d-구역 원소로 간주되어야 맞는 배치라고 언급했다.[27] 대량의 란타넘이 f-금속이라는 것은 곤도 준이 1963년에 저온 초전도 현상을 근거로 처음 제안했다.[102] 이는 원소를 구역별로 분류하고 표에 배치할 때 화학적 환경에서 역할을 할 수 있는 원자의 낮은 에너지에서 들뜬상태를 살펴보는 것의 중요성을 명확히 했다.[65][67][26] 많은 저자가 이후 물리적, 화학적, 전자적 관점에서 이 수정을 재발견하고 모든 관련 원소에 적용하여 3족에 스칸듐, 이트륨, 루테튬, 로렌슘을 포함하게 되었고[65][24][94] 란타넘부터 이터븀까지, 그리고 악티늄부터 노벨륨까지를 f-구역 행으로 만들었다.[65][24] 이 수정된 버전은 쌓음 원리와 일관성을 이루고 배싯, 베르너, 베리의 초기 화학적 배치를 입증한다.[34]
1988년 IUPAC는 3족의 이러한 구성을 지지하는 보고서를 발표했고,[24] 이 결정은 2021년에 재확인되었다.[25] 하지만 3족의 구성에 대한 변형은 여전히 교과서에서 찾아볼 수 있으며,[36] 이 형태에 대한 일부 다른 주장은 오늘날에도 출판되고 있지만,[64] 이 문제를 고려한 화학자와 물리학자는 대부분 3족에 스칸듐, 이트륨, 루테튬, 로렌슘이 포함된다는 데 동의하며 반대 주장을 일관성이 없다고 비판한다.[64]
합성 원소
[편집]
1936년까지 수소에서 우라늄 사이 누락된 원소는 4개로 줄어들었다. 이 시점에서 43, 61, 85, 87번 원소가 여전히 누락되어 있었다. 43번 원소는 결국 자연에서 발견된 것이 아니라 핵 반응을 통해 인공적으로 합성된 최초의 원소로 기록되었다. 이 원소는 1937년 이탈리아 화학자 에밀리오 지노 세그레와 카를로 페리에가 발견했으며, 그들은 그리스어로 "인공적인"이라는 단어에서 이름을 따서 테크네튬이라고 명명했다.[246] 61번 원소(프로메튬)와 85번 원소(아스타틴)도 마찬가지로 각각 1945년과 1940년에 인공적으로 생산되었다. 87번 원소(프랑슘)는 1939년 프랑스 화학자 마르게리트 페레가 자연에서 발견된 마지막 원소가 되었다.[247][u] 우라늄을 초과하는 원소도 마찬가지로 인공적으로 발견되었는데, 에드윈 맥미런과 필립 아벨슨이 1940년에 넵투늄을 발견(우라늄에 중성자를 충격하여)하면서 시작되었다.[77] 글렌 T. 시보그와 그의 LBNL 팀은 1941년 플루토늄을 시작으로 초우라늄 원소를 계속해서 발견했으며, 이전의 생각과는 달리 악티늄 이후의 원소가 전이 금속이 아니라 란타넘족 원소의 동족체라는 것을 발견했다.[248] 배싯(1892), 베르너(1905), 프랑스 엔지니어 샤를 자네트(1928)가 이전에 이를 주장했지만, 그들의 아이디어는 당시에는 학계에서 받아들여지지 않았다.[34] 따라서 시보그는 이들을 악티늄족이라고 불렀다.[248] 101번 원소(멘델레븀, 멘델레예프를 기려 명명됨)까지의 원소는 1955년까지 중성자 또는 알파 입자 조사, 또는 99번(아인슈타이늄)과 100번(페르뮴)의 경우 핵폭발을 통해 합성되었다.[77]
1960년대와 1970년대에 102번부터 106번 원소 사이에 대해 중대한 논쟁이 발생했는데, 앨버트 기오소가 이끄는 LBNL 팀과 게오르기 플료로프가 이끄는 소비에트 과학자 팀 간의 경쟁이 격화되었기 때문이었다. 각 팀은 서로 자신이 원소를 발견했다고 주장했으며, 일부의 경우 각자 원소에 대한 자체적인 이름을 제안하여 수십 년간 지속된 원소 명명 논란을 일으켰다. 이 원소는 악티늄족 원소에 가벼운 이온을 충돌시켜 만들어졌다.[249] IUPAC는 처음에는 합의가 이루어질지 기다리면서 방관적인 입장을 취했다. 그러나 냉전이 한창이던 시기였기 때문에 이것이 불가능하다는 것이 분명해졌다. 이에 따라 IUPAC와 IUPAP는 1985년에 트랜스페르뮴 연구단(TWG, 페르뮴은 100번 원소)을 구성하여 원소 발견 기준을 설정했고,[250] 이는 1991년에 발표되었다.[251] 추가적인 논란 끝에 이 원소는 1997년에 최종적으로 이름이 정해졌다. 여기에는 시보그를 기리는 시보귬(106번)도 포함되었다.[252]

TWG의 기준은 LBNL과 JINR뿐만 아니라 이후 독일(GSI)과 일본(이화학연구소)의 연구 기관 사이 원소 발견 주장을 중재하는 데 사용되었다.[253] 현재 원소 발견 주장 심사는 IUPAC/IUPAP 합동 실무단에서 수행한다. 우선권이 부여된다면 발견한 원소를 공식적으로 주기율표에 추가했고 발견자는 그 원소의 이름을 붙일 수 있는 자리에 초청받았다.[7] 2016년까지 118번까지의 모든 원소에 대해 이러한 절차가 이루어졌으며, 이에 따라 주기율표의 첫 7개 줄이 완성되었다.[7][254] 106번 이후 원소의 발견은 유리 오가네샨이 JINR에서 고안한 기술 덕분에 가능했다. 냉핵융합(납과 비스무트에 중이온을 충돌시킴)으로 1981년부터 2004년까지 GSI에서 107번부터 112번 원소, 이화학연구소에서 113번 원소가 발견되었고, 그는 1998년부터 2010년까지 고온 핵융합(악티늄족 원소에 칼슘 이온을 충돌시킴)을 사용하여 114번부터 118번 원소를 발견하는 JINR 팀을 이끌었다(미국 과학자들과 협력).[255][256] 가장 무거운 원소인 오가네손(118번)은 오가네샨의 이름을 따서 명명되었다. 114번 원소는 그의 전임자이자 스승인 플료로프를 기려 플레로븀으로 명명되었다.[256]
주기율표 탄생 150주년을 기념하여, 유엔은 2019년을 국제 주기율표의 해로 선포하며 "과학에서 가장 중요한 성과 중 하나"를 기념했다.[257] TWG가 설정한 발견 기준은 1991년에는 예측하지 못했던 실험적, 이론적 진보에 대응하여 2020년에 업데이트되었다.[258] 오늘날 주기율표는 화학에서 가장 뚜렷한 성과 중 하나이다.[83] IUPAC는 새로운 원소의 인정 및 명명, 족 번호 및 집단 이름 추천, 원자량 업데이트 등 오늘날 주기율표와 관련된 많은 과정에 관여하고 있다.[7]
7주기 너머로의 주기율표 확장
[편집]
가장 최근에 명명된 원소인 니호늄(113), 모스코븀(115), 테네신(117), 오가네손(118)의 발견으로 주기율표의 일곱 번째 줄이 완성되었다.[7] 미래에 발견될 원소는 여덟 번째 줄을 채워야 한다. 이 원소는 원자 번호(예: "164번 원소")로 불리거나, 1978년에 채택된 IUPAC 체계적 원소 이름(예: 164번 원소의 경우 라틴어 unus "하나", 그리스어 hexa "여섯", 라틴어 quadra "넷" 및 금속 원소의 전통적인 -ium 접미사에서 파생된 "운헥스콰듐")으로 부를 수 있다.[7] 지금까지 8주기 원소를 합성하려는 모든 시도는 실패했다. 119번 원소를 만들려는 시도는 2018년부터 일본의 이화학연구소에서 진행 중이다. 미국의 LBNL, 러시아의 JINR, 중국의 란저우시의 중이온연구시설(HIRFL)도 처음 몇 개의 8주기 원소를 합성하려는 자체적인 시도를 계획하고 있다.[261][262][263][264][265][266]
8주기가 이전 주기와 동일한 패턴을 따른다면, 8s, 5g, 6f, 7d, 마지막으로 8p 부껍질을 채우는 50개의 원소가 포함될 것이다. 하지만 이 시점부터는 상대론적 효과 때문에 쌓음 원리에서 상당한 오차가 발생할 것이다. 8주기 원소의 배열과 주기율표에 결과를 표시하는 방법에 대해 다양한 모델이 제안되었다. 모든 모델은 8주기가 이전 주기와 마찬가지로 두 개의 8s 원소인 119번과 120번으로 시작해야 한다는 데에는 동의한다. 그러나 그 이후에는 5g, 6f, 7d, 8p 부껍질이 전부 엄청나게 에너지가 겹치기 때문에 거의 모든 부껍질이 함께 채워지기 시작하며, 특정 5g 및 6f 계열 전자 쌓음을 분리하는 방법이 명확하지 않다.[60][267][268][269][270] 따라서 121번부터 156번까지의 원소는 주기율표의 이전 부분에 있는 어떤 구역과도 화학적으로 잘 들어맞지 않지만,[130] 형식적으로는 이들의 전자 배열을 반영하기 위해 5g, 6f, 기타 계열로 배치되기도 했다.[130] 에릭 스체리는 이 영역에서 마델룽 규칙이 들어맞지 않는 것을 확장 주기율표가 고려해야 하는지, 아니면 그러한 예외를 무시해야 하는지에 대한 의문을 제기했다.[267] 이 시점에서는 껍질 구조가 상당히 형식적일 수도 있다. 이미 오가네손 원자의 전자 분포는 뚜렷한 껍질 구조가 없이 상당히 균일할 것으로 예상된다.[271]
157번부터 172번까지의 상황은 정상으로 돌아와 이전 주기와 더 유사할 것으로 예상된다.[260] 무거운 p-껍질은 스핀-궤도 상호작용에 따라 분리된다. 하나의 p 궤도(p1/2)는 더 안정화되고, 다른 두 개(p3/2)는 불안정화된다.(이러한 양자수 변화는 모든 종류의 껍질에서 발생하지만, p-껍질의 경우 전자가 쌓이는 순서에 가장 큰 영향을 미친다.) 157번 원소에 이르면 총 4개의 전자를 가진 8s 및 8p1/2 껍질이 내부 껍질로 가라앉을 가능성이 높다. 내부 너머에는 비슷한 에너지의 7d와 9s 궤도가 뒤따르고, 그 다음 비슷한 에너지의 9p1/2와 8p3/2 궤도가 있으며, 그 다음에는 큰 간격이 있다.[260] 따라서 9s와 9p1/2 궤도는 본질적으로 8s와 8p1/2 궤도를 대체하여, 157번부터 172번까지의 원소가 아마도 3족부터 18족까지와 화학적으로 유사하게 될 것이다. 예를 들어, 164번 원소는 일반적인 패턴에 따르면 납 아래 14족에 나타날 것이지만, 실제로는 10족의 팔라듐과 매우 유사할 것으로 계산된다.[55][269][60][259][130] 따라서 118번 이후 다음 비활성 원소에 도달하려면 50개가 아닌 54개의 원소가 필요하다.[272] 그러나 157번부터 172번까지의 원소의 화학적 특성에 대한 이러한 결론은 모델 간에 대체로 비슷한 결과가 나와 동의하지만,[130][60] 주기율표가 화학적 유사성을 반영해야 하는지, 아니면 이전 주기와는 상당히 다를 것으로 예상되고 각 출처 간에 합의되지 않은 형식적인 전자 배열을 반영해야 하는지에 대한 의견 차이가 있다. 따라서 8주기의 형태에 대한 논의는 계속된다.[60][269][270][106]
172번 원소 이후의 계산은 1s 전자 에너지 준위가 허수가 되면서 복잡해진다. 이러한 상황은 물리적 해석을 가지며 주기율표에 전자적 한계를 자체적으로 제시하지는 않지만, 이러한 상태를 다전자 계산에 통합하는 올바른 방법은 여전히 이 지점 이후의 주기율표 구조를 계산하기 위해 해결해야 할 미해결 문제이다.[273]
핵의 안정성이 가능한 원소의 수를 제한하는 결정적인 요인이 될 것이다. 이는 양성자 사이의 전기적 반발력과 양성자 및 중성자를 함께 묶는 강한 핵력 사이의 균형에 달려 있다.[274] 양성자와 중성자는 전자와 마찬가지로 껍질에 배열되어 있으며, 닫힌 껍질은 안정성을 크게 늘릴 수 있다. 알려진 초중핵은 이러한 껍질 닫힘, 아마도 114~126번 원소 사이 양성자와 184번 원소의 중성자 근처에서 발생하기 때문에 존재한다.[273] 이는 아마도 안정성의 섬이라고 예측되는 곳에 가까이 있을 것이며, 여기서 초중핵은 예상보다 더 오래 생존할 수 있다고 예상된다. 이 섬에서 가장 오래 지속되는 핵종에 대한 예측은 마이크로초에서 수백만 년에 이른다.[106][275][276] 하지만 이러한 예측은 본질적으로 핵종 차트의 미지의 부분을 추정을 통해 외삽한 값이며, 체계적인 모델 불확실성을 고려해야 한다는 점에 유의해야 한다.[106]
닫힌 껍질을 넘어서면 안정화 효과가 사라질 것으로 예상된다.[277] 따라서 184개 이상의 중성자를 가진 초중핵종은 훨씬 짧은 수명을 가지며 10−15초 이내에 자발적으로 핵분열할 것으로 예상된다. 만약 그렇다면, 이를 화학 원소로 간주하는 것은 의미가 없을 것이다. IUPAC/IUPAP는 핵이 전자 구름을 모으는 데 필요한 시간인 10−14초보다 오래 생존할 때만 원소가 존재한다고 이론화하고 권고한다. 그럼에도 불구하고, 반감기에 대한 이론적 추정치는 모델에 매우 의존적이며, 여러 자릿수의 오차범위로 다양하게 나타난다.[273] 양성자 사이의 극심한 반발은 기포, 고리, 토러스와 같은 특이한 핵 위상을 만들어 낼 것으로 예측된다. 이는 외삽을 더욱 복잡하게 만든다.[106] 뚜렷한 핵 껍질의 예상되는 흐려짐(오가네손의 전자 껍질에서도 이미 예상됨) 때문에 더 바깥쪽 껍질 닫힘이 존재하는지는 불분명하다.[277] 또한, 나중에 껍질 닫힘이 존재하더라도 그러한 무거운 원소가 존재할 수 있게 할지는 불분명하다.[278][279][280][180] 따라서 주기율표는 120번 원소 근처에서 실질적으로 끝날 수도 있다. 원소의 수명이 너무 짧아 관찰할 수 없게 되고, 화학적 특성을 가질 수 없을 정도로 수명이 짧아지기 때문이다. 새로운 원소를 발견하는 시대는 따라서 거의 끝나가고 있을 것이다.[180][281] 126번을 넘어 또 다른 양성자 껍질 닫힘이 존재한다면, 이는 아마도 164번 근처에서 발생할 것이다.[278] 따라서 주기성이 붕괴되는 영역은 대략적으로 껍질 닫힘 사이의 불안정 영역과 일치한다.[130]
또는 핵이 양성자와 중성자로 결합하는 대신 자유롭게 흐르는 위 쿼크와 아래 쿼크로 구성될 때, 쿼크 물질이 높은 질량수에서 안정해질 수 있다. 이는 안정성의 섬 대신 안정성의 대륙을 만들 것이다.[282][283] 다른 효과도 작용할 수 있다. 예를 들어, 매우 무거운 원소에서는 1s 전자가 핵에 너무 가까이 머무르면서 실제로 핵 내부에 있는 시간이 상당할 것으로 예상되는데, 이는 전자 포획에 취약하게 만들 것이다.[284]
여덟 번째 줄 원소가 존재할 수 있다고 하더라도 이를 생성하는 것은 어려울 가능성이 높고, 원자 번호가 증가함에 따라 더욱 어려워질 것이다.[285] 8s 원소인 119번과 120번은 현재의 수단으로 합성 가능할 것으로 예상되지만, 그 이후의 원소는 새로운 기술을 필요로 할 것으로 예상된다.[286] 만약 생산될 수 있다면 말이다.[287] 이 원소를 화학적으로 특성화하는 것도 큰 도전이 될 것이다.[261]
대안 주기율표
[편집]
주기율은 여러 가지 방식으로 표현될 수 있으며, 표준 주기율표는 그 중 하나일 뿐이다.[288] 1869년 멘델레예프 표가 등장한 지 100년 안에 에드워드 G. 마주르스는 약 700개의 다른 모양의 출판된 주기율표를 수집했다.[183][289] 많은 형태가 직사각형 구조를 유지하는데, 여기에는 샤를 자네트의 왼쪽 계단 주기율표(아래 그림)와 러시아에서 여전히 흔히 사용되는 멘델레예프의 원래 8열 배열의 현대화된 형태가 포함된다. 기타 다른 주기율표 형식으로 나선형(오토 테오도어 벤페이의 그림이 오른쪽에 있음), 원형, 삼각형과 같이 훨씬 더 특이한 형태로 만들어진 주기율표도 있다.[290]
대안 주기율표는 전통적인 주기율표에서는 덜 명확한 원소의 화학적 또는 물리적 특성을 강조하거나 부각시키기 위해 개발되는 경우가 많으며, 어떤 표는 화학을, 어떤 표는 물리학을 더 강조하는 경향이 있다.[291] 가장 일반적인 형태인 표준형은 두 분야의 중간쯤에 위치한다.[291]
주기율표의 다양한 형태는 주기율표의 최적 또는 최종 형태가 있는지, 있다면 무엇인지에 대한 질문을 제기했다. 이 두 질문에 대한 현재 합의된 답은 없다.[292][291] 자네트의 왼쪽 계단형 주기율표는 최적 또는 가장 근본적인 형태가 될 수 있는 후보로 점점 더 논의되고 있다. 스체리는 이 표가 헬륨의 s-구역 원소로서의 본질을 명확히 하고, 모든 주기의 길이가 동일하게 반복되어 규칙성을 높이며, 각 주기를 하나의 n + ℓ 값에 대응시킴으로써 마델룽 규칙을 충실히 따르고,[g] 원자 번호의 3원소와 첫 줄 이상 현상 추세를 규칙화하기 때문에 이를 지지한다. 그는 헬륨을 알칼리 토금속 위에 배치하는 것이 화학적 관점에서 단점으로 보일 수 있다는 점을 지적하면서도, 첫 줄 이상 현상에 호소하여 주기율표가 "근본적으로 양자역학으로 귀결"되며, "추상 원소"에 관한 것이므로 거시적 특성보다는 원자 특성에 관한 것이라고 반박한다.[297]
| f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | s1 | s2 | |||
| 1s | H | He | ||||||||||||||||||||||||||||||||
| 2s | Li | Be | ||||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra | ||
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | Uue | Ubn | ||
| F-구역 | D-구역 | P-구역 | S-구역 | |||||||||||||||||||||||||||||||
같이 보기
[편집]각주
[편집]- 내용주
- ↑ 가 나 자연에 존재하는 원소의 수는 상당히 복잡하고 완전히 해결되지 않은 문제이다. 지구상에 다량으로 존재하는 가장 무거운 원소는 원자번호 92, 우라늄이다. 그러나 우라늄은 자연에서 자발 핵분열을 겪을 수 있으며, 그 결과 발생하는 중성자는 다른 우라늄 원자에 부딪힐 수 있다. 만약 중성자 포획이 발생하면, 원소 93과 94인 넵투늄과 플루토늄이 베타 붕괴를 통해 형성된다.[11] 이들은 실제로 프로메튬, 아스타틴, 프랑슘과 같은 처음 92개 원소 중 가장 희귀한 원소들보다 더 흔하게 존재한다 (지구 지각 내 원소 존재비를 참조하라). 이론적으로는 이렇게 만들어진 플루토늄에 중성자 포획이 발생한다면 훨씬 더 높은 번호의 원소를 생성할 수 있지만, 그 양은 관찰하기에는 너무 작다고 추정된다.[11] 초기 태양계에서는 수명이 짧은 원소가 아직 붕괴되지 않았고, 그 때문에 원지번호 94 이상의 자연 발생 원소가 존재했다. 퀴륨(원자번호 96)은 처음 94개를 넘는 원소 중 가장 수명이 긴 원소이며, 아마도 우주선을 통해 지구로 계속 유입될 수 있지만 실제로 발견되지는 않았다.[11] 프시빌스키의 별 스펙트럼에서 아인슈타이늄(원자번호 99)까지의 원소들이 관찰되었다.[12] 페르뮴(원자번호 100)까지의 원소는 가봉 오클로 천연원자로에서 아마도 생성되었다고 추정되지만 오래전에 붕괴되어 사라졌다.[13] 심지어 더 무거운 원소도 초신성이나 중성자별 병합을 통해 R-과정에서 생성될 수 있지만, 이는 확인되지 않았다. 원자번호 100을 넘어 얼마나 멀리 확장될 수 있고 또한 얼마나 오래 지속될지는 불분명하다. 계산에 따르면 질량수 280에서 290 사이의 핵종이 R-과정에서 형성되지만, 빠르게 베타 붕괴하여 자발 핵분열을 겪는 핵종이 되어 생성된 초중원소 핵종의 99.9%가 한 달 이내에 붕괴될 것으로 예상된다.[14] 만약 대신 충분히 오래 지속된다면, 마찬가지로 우주선을 통해 지구로 유입될 수 있겠지만, 다시 말하지만 아무것도 발견되지 않았다.[11]
- ↑ 현재 안정하다고 간주되는 일부 동위 원소는 이론적으로 매우 긴 반감기를 가진 방사성 물질일 것으로 예상된다. 예를 들어, 원자번호 62(사마륨), 63(유로퓸), 67(홀뮴) 이후의 모든 원소의 안정 동위 원소는 알파 붕괴 또는 이중 베타 붕괴를 겪을 것으로 예상된다. 그러나 예측된 반감기는 극도로 길며(예: 208Pb의 기저 상태 204Hg로의 알파 붕괴는 10120년보다 긴 반감기를 가질 것으로 예상된다), 이러한 붕괴는 관찰된 적이 없다.[17][18]
- ↑ 플루토늄의 가장 안정한 동위 원소의 반감기는 원시 원소로 존재하기에 충분히 길다. 1971년 연구에서는 원시 플루토늄이 검출되었다고 주장했지만,[19] 2012년의 더 최근 연구에서는 검출되지 않았다.[20] 태양계에서의 초기 존재비를 바탕으로, 2022년 기준의 실험은 살아있는 원시 244Pu를 검출하는 데 약 한 자릿수 정도 남은 것으로 보인다.[21]
- ↑ 플루토늄 미량 또한 우주선을 통해 지구로 계속 유입된다.[22]
- ↑ 예를 들어 Sigma-Aldrich에서 판매하는 주기율표 포스터를 참조하시오.
- ↑ 엄밀히 말하면, 전자가 그 안에 반드시 있다는 것을 보장하는 궤도를 그릴 수는 없지만 예를 들어 90%의 확률로 전자가 그 안에 있다는 것을 보장하는 궤도를 그릴 수는 있다.[42]
- ↑ 가 나 저자는 n + ℓ 규칙이 양자역학에서 도출되었는지 여부에 대해 의견이 다르다. 스체리는 몇 차례 시도에도 불구하고 아직 도출되지 않았다고 주장한다.[293][294] 반면, 1971년부터 그러한 정당성을 주장해 온 오스트로프스키는 "여전히 아무도 'n+ℓ 규칙을 양자역학 원리에서 도출하지 못했다'고 주장하는 저자가 있는 반면, 다른 저자는 논란의 여지가 없는 규칙의 양자적 정당성을 제시한다"고 썼다.[295] 다른 저자는 예외를 인정하기 때문에 그런 유도가 불필요하다고 주장한다.[296]
- ↑ 전자 2개에서 4개가 제거되면 d 및 f 궤도는 보통 s 궤도보다 에너지가 낮아진다.[53]
- 1s ≪ 2s < 2p ≪ 3s < 3p ≪ 3d < 4s < 4p ≪ 4d < 5s < 5p ≪ 4f < 5d < 6s < 6p ≪ 5f < 6d < 7s < 7p ≪ ...
- Cs0: 6s < 6p < 5d < 7s < 4f
- Ba+: 6s < 5d < 6p < 7s < 4f
- La2+: 5d < 4f < 6s < 6p < 7s
- Ce3+: 4f < 5d < 6s < 6p < 7s
- ↑ 사실 전자 배열은 일차 근사치이다. 원자는 실제로 여러 배열의 중첩 상태로 존재하며, 원자 내의 전자는 구별할 수 없다.[29] d-구역과 f-구역의 원소들은 작은 에너지 차이로 분리된 여러 배열을 가지고 있으며, 화학적 환경에 따라 배열이 바뀔 수 있다.[53] 아직 발견되지 않은 g-구역 원소 중 일부에서는 배열의 혼합이 너무 중요해져서 단일 배열로 잘 설명할 수 없게 될 수도 있다.[60]
- ↑ 니호늄의 6d 궤도를 원자가 궤도로 사용하는 화합물이 이론적으로 연구되었지만, 모두 너무 불안정하여 관찰할 수 없을 것으로 예상된다.[73]
- ↑ p-구역 원소의 특성은 후속 s-구역 원소에 영향을 미친다. 나트륨의 3s 껍질은 카이노시메트릭 2p 코어 위에 있지만, 칼륨의 4s 껍질은 훨씬 더 큰 3p 코어 위에 있다. 따라서 칼륨 원자가 나트륨 원자보다 더 클 것으로 이미 예상되었겠지만, 크기 차이는 평소보다 더 크다.[98]
- ↑ 이보다 더 낮은 산화물도 많다. 예를 들어, 15족의 인은 두 가지 산화물인 P2O3와 P2O5를 형성한다.[115]
- ↑ 일반적으로 "금지된" 중간 산화 상태는 이합체를 형성함으로써 안정화될 수 있다. 예를 들어 [Cl3Ga–GaCl3]2−(갈륨은 +2 산화 상태) 또는 S2F10 (황은 +5 산화 상태)과 같다.[142] 이러한 중간 산화 상태인 것처럼 보이는 일부 화합물은 실제로는 Sb2O4와 같이 Sb(III)와 Sb(V)를 모두 포함하는 혼합 원자가 화합물이다.[143]
- ↑ 분산력과 금속 결합 사이의 경계는 이온 결합과 공유 결합 사이처럼 점진적이다. 특성적인 금속 특성은 작은 수은 클러스터에서는 나타나지 않지만, 큰 클러스터에서는 나타난다.[153]
- ↑ 이 모든 것은 표준 압력에서의 상황을 설명한다. 충분히 높은 압력에서는 모든 고체의 띠틈이 0으로 떨어지고 금속화가 발생한다. 따라서 예를 들어 약 170 킬로바에서 아이오딘은 금속이 되며,[154] 금속성 수소는 약 4백만 기압에서 형성되어야 한다.[156] 모든 비금속의 값은 금속화 압력을 참조하라.
- ↑ 그린우드와 언쇼 전반에 걸쳐 원소에 의해 형성된 구조에 대한 설명이 있다. 두 가지 경계선 경우가 있다. 비소의 가장 안정적인 형태는 금속처럼 전기를 전도하지만, 안티모니와 비스무트의 유사한 구조보다 가장 가까운 이웃에 대한 결합이 훨씬 더 국부적이며,[159] 일반적인 금속과 달리 액체 범위가 길지 않고 대신 승화한다. 따라서 그 구조는 네트워크 공유 결합으로 더 잘 다루어진다.[160] 흑연으로서의 탄소는 평면에 평행하게 금속 전도를 보이지만, 수직으로는 반도체이다. 일부 계산은 코페르니슘과 플레로븀이 비금속일 것으로 예측하지만,[161][162] 그들에 대한 가장 최근의 실험은 이들이 금속임을 시사한다.[163][164][165] 아스타틴은 표준 조건에서 금속화될 것으로 계산되므로,[166] 아마도 테네신도 그럴 것이다.[167]
- ↑ 원소의 녹는점 (데이터 문서)를 참조하라. 프랑슘도 마찬가지일 가능성이 있지만, 극심한 불안정성 때문에 실험적으로 확인된 적은 없다. 코페르니슘과 플레로븀은 수은과 유사하게 액체일 것으로 예상되며,[161][162] 실험적 증거는 이들이 금속임을 시사한다.[163][164][165]
- ↑ 가 나 준금속 목록을 참조하라. 예를 들어, 미국화학회에서 사용하는 주기율표는 폴로늄을 준금속으로 분류하지만,[178] 왕립화학회에서 사용하는 주기율표는 그렇지 않으며,[179] 브리태니커 백과사전에 포함된 주기율표는 준금속이나 반금속을 전혀 언급하지 않는다.[180] 분류는 단일 저서 내에서도 변경될 수 있다. 예를 들어, 셔윈과 웨스턴의 비금속 원소 화학(1966)은 7페이지의 주기율표에서 안티모니를 비금속으로 분류하지만, 115페이지에서는 금속으로 부른다.[181]
- ↑ 뎀코프와 오스트로프스키는 퍼텐셜을 고려하는데, 여기서 과 는 상수인 매개변수이다. 이 퍼텐셜은 작은 에 대해 쿨롱 퍼텐셜에 가까워진다. 가 조건 를 만족할 때, 여기서 이며, 이 퍼텐셜에 대한 슈뢰딩거 방정식의 영에너지 해는 게겐바우어 다항식으로 해석적으로 설명될 수 있다. 가 이 값을 통과할 때마다 값이 같은 모든 상태를 포함하는 다양체가 영에너지에서 발생하고 묶인 상태가 되면서 쌓음 원리에 따른 순서를 보여준다. 섭동 이론을 고려할 경우 더 작은 을 가진 상태가 더 낮은 에너지를 가지며, s 궤도( )는 그 에너지가 다음 그룹에 가까워진다는 것을 보여준다.[244][92]
- ↑ 예를 들어, 초기 악티늄족 원소는 악티늄부터 우라늄까지 높은 산화수를 가지는 경향에서 d-구역 전이 금속과 더 유사하게 행동한다. 비록 실제로는 악티늄과 토륨만이 기체 상태에서 d-구역과 유사한 배열을 가지지만, f-전자는 이미 전 악티늄족 원소에서 나타난다.[112] 우라늄의 실제 배열인 [Rn]5f36d17s2는 사실 훈트가 란타넘족 원소에 대해 가정한 것과 유사하지만, 우라늄은 3가 상태를 선호하지 않고 4가 또는 6가 상태를 선호한다.[55] 반면에 악티늄족에 대한 란타넘족과 유사한 배열은 플루토늄에서 시작되지만, 란타넘족과 유사한 행동으로 변화하는 모습은 퀴륨에서만 명확히 보인다. 우라늄과 퀴륨 사이의 원소는 전이 금속과 유사한 행동에서 란타넘족과 유사한 행동으로의 전이를 보인다.[112] 따라서 화학적 행동과 전자 배열은 정확히 일치하지 않는다.[112]
- ↑ 테크네튬, 프로메튬, 아스타틴, 넵투늄, 플루토늄은 결국 자연에서도 미량으로 존재한다는 것이 밝혀졌다. 원소 발견 연표를 참고하라.
- 출처
- ↑ 대한화학회 (2019년 3월 28일). “주기율표와 원소, 150년의 이야기”. 네이버 TV. 2025년 8월 28일에 확인함.
- ↑ “Periodic Table of Elements” (미국 영어). 《IUPAC | International Union of Pure and Applied Chemistry》. 2024년 5월 11일에 확인함.
- ↑ 메이아, 유리스 외 (2016). 《Atomic weights of the elements 2013 (IUPAC Technical Report)》. 《순수 및 응용 화학》 88. 265–291쪽. doi:10.1515/pac-2015-0305.
- ↑ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. (2022년 5월 4일). 《Standard atomic weights of the elements 2021 (IUPAC Technical Report)》 (영어). 《Pure and Applied Chemistry》. doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ↑ 중성자만으로 구성된 물질인 0족 원소가 일부 대체 주기율표에 포함되어 있다. 예를 들어 다음 웹사이트에서 확인할 수 있다. Labarca, M. (2016). 《An element of atomic number zero?》. 《New Journal of Chemistry》 40. 9002–9006쪽. doi:10.1039/C6NJ02076C. hdl:11336/46854. ISSN 1144-0546.를 참고하라.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). 온라인 수정 버전: (2006–) "Chemical element". doi:10.1351/goldbook.C01022
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 “Periodic Table of Elements”. 《iupac.org》. IUPAC. 2021. 2016년 4월 10일에 원본 문서에서 보존된 문서. 2021년 4월 3일에 확인함.
- ↑ “Standard Atomic Weights”. 《Commission on Isotopic Abundances and Atomic Weights》. International Union of Pure and Applied Chemistry. 2019. 2020년 8월 8일에 원본 문서에서 보존된 문서. 2021년 2월 7일에 확인함.
- ↑ Greenwood & Earnshaw, pp. 24–27
- ↑ Gray, p. 6
- ↑ 가 나 다 라 마 Thornton, Brett F.; Burdette, Shawn C. (2019). 《Neutron stardust and the elements of Earth》. 《Nature Chemistry》 11. 4–10쪽. Bibcode:2019NatCh..11....4T. doi:10.1038/s41557-018-0190-9. PMID 30552435. S2CID 54632815. 2021년 8월 14일에 원본 문서에서 보존된 문서. 2022년 2월 19일에 확인함.
- ↑ Gopka, V.F.; Yushchenko, A.V.; Yushchenko, V.A.; Panov, I.V.; Kim, Ch. (2008년 5월 15일). 《Identification of absorption lines of short half-life actinides in the spectrum of Przybylski's star (HD 101065)》. 《Kinematics and Physics of Celestial Bodies》 24. 89–98쪽. Bibcode:2008PPCB...24...89G. doi:10.3103/S0884591308020049. S2CID 120526363.
- ↑ 가 나 Emsley, John (2011). 《Nature's Building Blocks: An A-Z guide to the elements》 New판. New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ↑ Panov, I.V. (2017). 《Formation of Superheavy Elements in Nature》. 《Physics of Atomic Nuclei》 81. 57–65쪽. doi:10.1134/S1063778818010167. S2CID 125149409.
- ↑ Silva, Robert J. (2006). 〈Fermium, Mendelevium, Nobelium and Lawrencium〉 3판. Morss, L. R.; Edelstein, N. M.; Fuger, J. (편집). 《The Chemistry of the Actinide and Transactinide Elements》. Dordrecht: 슈프링어. ISBN 978-1-4020-3555-5.
- ↑ Marcillac, Pierre de; Noël Coron; Gérard Dambier; Jacques Leblanc; Jean-Pierre Moalic (April 2003). 《Experimental detection of α-particles from the radioactive decay of natural bismuth》. 《네이처》 422. 876–878쪽. Bibcode:2003Natur.422..876D. doi:10.1038/nature01541. PMID 12712201. S2CID 4415582.
- ↑ Belli, P.; Bernabei, R.; Danevich, F. A. 외 (2019). 《Experimental searches for rare alpha and beta decays》. 《European Physical Journal A》 55. 140–1–140–7쪽. arXiv:1908.11458. Bibcode:2019EPJA...55..140B. doi:10.1140/epja/i2019-12823-2. ISSN 1434-601X. S2CID 201664098.
- ↑ Tretyak, V.I.; Zdesenko, Yu.G. (2002). 《Tables of Double Beta Decay Data — An Update》. 《At. Data Nucl. Data Tables》 80. 83–116쪽. Bibcode:2002ADNDT..80...83T. doi:10.1006/adnd.2001.0873.
- ↑ Hoffman, D. C.; Mewherter; Rourke, F. M. (1971). 《Detection of Plutonium-244 in Nature》. 《네이처》 234. 132–134쪽. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0. S2CID 4283169. 이름 목록에서
|이름2=이(가) 있지만|성2=이(가) 없음 (도움말) - ↑ Lachner, J. 외 (2012). 《Attempt to detect primordial 244Pu on Earth》. 《Physical Review C》 85. 015801쪽. Bibcode:2012PhRvC..85a5801L. doi:10.1103/PhysRevC.85.015801.
- ↑ Wu, Yang; Dai, Xiongxin; Shan, Xing; Luo; Christl; Synal; Hou (2022). 《Direct search for primordial 244Pu in Bayan Obo bastnaesite》. 《Chinese Chemical Letters》 33. 3522–3526쪽. doi:10.1016/j.cclet.2022.03.036. S2CID 247443809. 2024년 1월 29일에 확인함.
- ↑ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G. 외 (2015). 《Abundance of live 244Pu in deep-sea reservoirs on Earth points to rarity of actinide nucleosynthesis》. 《Nature Communications》 6. 5956쪽. arXiv:1509.08054. Bibcode:2015NatCo...6.5956W. doi:10.1038/ncomms6956. ISSN 2041-1723. PMC 4309418. PMID 25601158.
- ↑ 가 나 다 라 마 바 사 아 Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; Hutton, A. T. (2005). 《Nomenclature of Inorganic Chemistry: IUPAC Recommendations 2005》 (PDF). RSC Publishing. 51쪽. ISBN 978-0-85404-438-2. 2018년 11월 23일에 원본 문서 (PDF)에서 보존된 문서. 2018년 11월 26일에 확인함.
- ↑ 가 나 다 라 마 바 사 아 자 Fluck, E. (1988). 《New Notations in the Periodic Table》 (PDF). 《Pure Appl. Chem.》 60. 431–436쪽. doi:10.1351/pac198860030431. S2CID 96704008. 2012년 3월 25일에 원본 문서 (PDF)에서 보존된 문서. 2012년 3월 24일에 확인함.
- ↑ 가 나 다 라 마 바 사 아 Scerri, Eric (2021년 1월 18일). 《Provisional Report on Discussions on Group 3 of the Periodic Table》 (PDF). 《Chemistry International》 43. 31–34쪽. doi:10.1515/ci-2021-0115. S2CID 231694898. 2021년 4월 13일에 원본 문서 (PDF)에서 보존된 문서. 2021년 4월 9일에 확인함.
- ↑ 가 나 다 라 마 바 사 아 자 차 William B. Jensen (1982). 《The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table》. 《J. Chem. Educ.》 59. 634–636쪽. Bibcode:1982JChEd..59..634J. doi:10.1021/ed059p634.
- ↑ 가 나 다 L. D. Landau, E. M. Lifshitz (1958). 《Quantum Mechanics: Non-Relativistic Theory》 1판 3. Pergamon Press. 256–7쪽.
- ↑ Jensen, William B. (2015). 《The positions of lanthanum (actinium) and lutetium (lawrencium) in the periodic table: an update》. 《Foundations of Chemistry》 17. 23–31쪽. doi:10.1007/s10698-015-9216-1. S2CID 98624395. 2021년 1월 30일에 원본 문서에서 보존된 문서. 2021년 1월 28일에 확인함.
- ↑ 가 나 다 Scerri, Eric (2009). 《Which Elements Belong in Group 3?》. 《Journal of Chemical Education》 86. 1188쪽. doi:10.1021/ed086p1188. 2023년 1월 1일에 확인함.
- ↑ 가 나 Chemey, Alexander T.; Albrecht-Schmitt, Thomas E. (2019). 《Evolution of the periodic table through the synthesis of new elements》. 《Radiochimica Acta》 107. 1–31쪽. doi:10.1515/ract-2018-3082.
- ↑ 가 나 다 라 마 바 사 아 자 차 Petrucci et al., p. 331
- ↑ Pfeiffer, Paul (1920). 《Die Befruchtung der Chemie durch die Röntgenstrahlenphysik》 (독일어). 《Naturwissenschaften》 8. 984–991쪽. Bibcode:1920NW......8..984P. doi:10.1007/BF02448807. S2CID 7071495.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 거 너 더 러 머 버 Gonick, First; Criddle, Craig (2005). 《The Cartoon Guide to Chemistry》. Collins. 17–65쪽. ISBN 0-06-093677-0.
- ↑ 가 나 다 라 마 바 사 아 자 차 Thyssen, P.; Binnemans, K. (2011). 〈Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis〉. Gschneidner, K. A. Jr.; Bünzli, J-C.G; Vecharsky, Bünzli (편집). 《Handbook on the Physics and Chemistry of Rare Earths》 41. Amsterdam: Elsevier. 1–93쪽. doi:10.1016/B978-0-444-53590-0.00001-7. ISBN 978-0-444-53590-0.
- ↑ Scerri, p. 375
- ↑ 가 나 “The constitution of group 3 of the periodic table”. IUPAC. 2015. 2016년 7월 5일에 원본 문서에서 보존된 문서. 2016년 7월 30일에 확인함.
- ↑ 가 나 Scerri, p. 17
- ↑ “periodic law”. 《메리엄-웹스터 사전》.
- ↑ 가 나 다 Jensen, William B. (2009). 《Misapplying the Periodic Law》. 《Journal of Chemical Education》 86. 1186쪽. Bibcode:2009JChEd..86.1186J. doi:10.1021/ed086p1186.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 Feynman, Richard; Leighton, Robert B.; Sands, Matthew (1964). 〈19. The Hydrogen Atom and The Periodic Table〉. 《The Feynman Lectures on Physics》 3. Addison–Wesley. ISBN 0-201-02115-3. 2021년 10월 19일에 원본 문서에서 보존된 문서. 2021년 8월 15일에 확인함.
- ↑ Petrucci et al., p. 323
- ↑ Petrucci et al., p. 306
- ↑ Petrucci et al., p. 322
- ↑ Ball, David W.; Key, Jessie A. (2011). 《Introductory Chemistry》 1 Canadian판. Vancouver, British Columbia: BC Campus (opentextbc.ca). ISBN 978-1-77420-003-2. 2021년 8월 15일에 원본 문서에서 보존된 문서. 2021년 8월 15일에 확인함.
- ↑ “Electron Configurations”. 《www.chem.fsu.edu》. Florida State University. 2020년 5월 6일. 2022년 5월 6일에 원본 문서에서 보존된 문서. 2022년 4월 17일에 확인함.
- ↑ 가 나 다 라 Goudsmit, S. A.; Richards, Paul I. (1964). 《The Order of Electron Shells in Ionized Atoms》 (PDF). 《Proc. Natl. Acad. Sci.》 51. 664–671 (with correction on p 906)쪽. Bibcode:1964PNAS...51..664G. doi:10.1073/pnas.51.4.664. PMC 300183. PMID 16591167. 2017년 10월 10일에 원본 문서 (PDF)에서 보존된 문서. 2021년 8월 15일에 확인함.
- ↑ Jolly, William L. (1984). 《Modern Inorganic Chemistry》 1판. McGraw-Hill. 10–12쪽. ISBN 0-07-032760-2.
- ↑ 가 나 다 라 마 Ostrovsky, V. N. (May 2001). 《What and How Physics Contributes to Understanding the Periodic Law》. 《Foundations of Chemistry》 3. 145–181쪽. doi:10.1023/A:1011476405933. S2CID 15679915.
- ↑ 가 나 Ostrovsky, V. N. (1981). 《Dynamic symmetry of atomic potential》. 《Journal of Physics B: Atomic and Molecular Physics》 14. 4425–4439쪽. Bibcode:1981JPhB...14.4425O. doi:10.1088/0022-3700/14/23/008.
- ↑ 가 나 Wong, D. Pan (1979). 《Theoretical justification of Madelung's rule》. 《J. Chem. Educ.》 56. 714–718쪽. Bibcode:1979JChEd..56..714W. doi:10.1021/ed056p714.
- ↑ 가 나 다 Petrucci et al., p. 328
- ↑ 가 나 Cao, Changsu; Vernon, René E.; Schwarz, W. H. Eugen; Li (2021년 1월 6일). 《Understanding Periodic and Non-periodic Chemistry in Periodic Tables》. 《Frontiers in Chemistry》 8. 813쪽. Bibcode:2021FrCh....8..813S. doi:10.3389/fchem.2020.00813. PMC 7818537. PMID 33490030.
- ↑ 가 나 다 라 마 바 사 Jørgensen, Christian (1973). 《The Loose Connection between Electron Configuration and the Chemical Behavior of the Heavy Elements (Transuranics)》. 《Angewandte Chemie International Edition》 12. 12–19쪽. doi:10.1002/anie.197300121.
- ↑ 가 나 El'yashevich, M. A. (1953). 《Spectra of the Rare Earths》. Moscow: State Publishing House of Technical-Theoretical Literature. 382, 397쪽.
- ↑ 가 나 다 라 마 Jørgensen, Christian Klixbüll (1988). 〈Influence of Rare Earths on Chemical Understanding and Classification〉. Gschneidner Jr., Karl A.; Eyring, Leroy (편집). 《Handbook on the Physics and Chemistry of Rare Earths》 11. Elsevier. 197–292쪽. ISBN 978-0-444-87080-3.
- ↑ NIST (2023). “NIST Atomic Spectra Database: Ionization Energies Data: All Ho-like”. 《nist.gov》. NIST. 2024년 1월 5일에 확인함.
- ↑ Tossell, J.A. (1977년 11월 1일). 《Theoretical studies of valence orbital binding energies in solid zinc sulfide, zinc oxide, and zinc fluoride》. 《Inorganic Chemistry》 16. 2944–2949쪽. doi:10.1021/ic50177a056.
- ↑ 가 나 다 라 마 바 사 아 자 차 Keeler, James; Wothers, Peter (2014). 《Chemical Structure and Reactivity》 2판. Oxford University Press. 257–260쪽. ISBN 978-0-19-9604135.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 거 너 더 러 머 버 서 어 저 처 커 Jensen, William B. (2000). “The Periodic Law and Table” (PDF). 2020년 11월 10일에 원본 문서 (PDF)에서 보존된 문서. 2022년 12월 10일에 확인함.
- ↑ 가 나 다 라 마 Nefedov, V.I.; Trzhaskovskaya, M.B.; Yarzhemskii, V.G. (2006). 《Electronic Configurations and the Periodic Table for Superheavy Elements》 (PDF). 《Doklady Physical Chemistry》 408. 149–151쪽. doi:10.1134/S0012501606060029. ISSN 0012-5016. S2CID 95738861. 2016년 10월 13일에 원본 문서 (PDF)에서 보존된 문서. 2021년 8월 15일에 확인함.
- ↑ Wulfsberg, p. 27
- ↑ 가 나 Petrucci et al., pp. 326–7
- ↑ Farberovich, O. V.; Kurganskii, S. I.; Domashevskaya, E. P. (1980). 《Problems of the OPW Method. II. Calculation of the Band Structure of ZnS and CdS》. 《Physica Status Solidi B》 97. 631–640쪽. Bibcode:1980PSSBR..97..631F. doi:10.1002/pssb.2220970230.
- ↑ 가 나 다 라 Jensen, William B. (2015). 《The positions of lanthanum (actinium) and lutetium (lawrencium) in the periodic table: an update》. 《Foundations of Chemistry》 17. 23–31쪽. doi:10.1007/s10698-015-9216-1. S2CID 98624395. 2021년 1월 30일에 원본 문서에서 보존된 문서. 2021년 1월 28일에 확인함.
- ↑ 가 나 다 라 마 Hamilton, David C. (1965). 《Position of Lanthanum in the Periodic Table》. 《American Journal of Physics》 33. 637–640쪽. Bibcode:1965AmJPh..33..637H. doi:10.1119/1.1972042.
- ↑ 가 나 다 Krinsky, Jamin L.; Minasian, Stefan G.; Arnold, John (2010년 12월 8일). 《Covalent Lanthanide Chemistry Near the Limit of Weak Bonding: Observation of (CpSiMe3)3Ce−ECp* and a Comprehensive Density Functional Theory Analysis of Cp3Ln−ECp (E = Al, Ga)》. 《Inorganic Chemistry》 50 (American Chemical Society (ACS)). 345–357쪽. doi:10.1021/ic102028d. ISSN 0020-1669. PMID 21141834.
- ↑ 가 나 다 Jensen, W. B. (2015). “Some Comments on the Position of Lawrencium in the Periodic Table” (PDF). 2015년 12월 23일에 원본 문서 (PDF)에서 보존된 문서. 2015년 9월 20일에 확인함.
- ↑ Wang, Fan; Le-Min, Li (2002). 《镧系元素 4f 轨道在成键中的作用的理论研究》 [Theoretical Study on the Role of Lanthanide 4f Orbitals in Bonding] (중국어). 《Acta Chimica Sinica》 62. 1379–84쪽.
- ↑ Xu, Wei; Ji, Wen-Xin; Qiu, Yi-Xiang; Schwarz, W. H. Eugen; Wang, Shu-Guang (2013). 《On structure and bonding of lanthanoid trifluorides LnF3 (Ln = La to Lu)》. 《Physical Chemistry Chemical Physics》 2013. 7839–47쪽. Bibcode:2013PCCP...15.7839X. doi:10.1039/C3CP50717C. PMID 23598823.
- ↑ Chi, Chaoxian; Pan, Sudip; Jin, Jiaye; Meng, Luyan; Luo, Mingbiao; Zhao, Lili; Zhou, Mingfei; Frenking, Gernot (2019). 《Octacarbonyl Ion Complexes of Actinides [An(CO)8]+/− (An=Th, U) and the Role of f Orbitals in Metal–Ligand Bonding》. 《Chem. Eur. J.》 25. 11772–11784쪽. doi:10.1002/chem.201902625. PMC 6772027. PMID 31276242.
- ↑ Singh, Prabhakar P. (1994). 《Relativistic effects in mercury: Atom, clusters, and bulk》. 《Physical Review B》 49. 4954–4958쪽. Bibcode:1994PhRvB..49.4954S. doi:10.1103/PhysRevB.49.4954. PMID 10011429.
- ↑ Hu, Shu-Xian; Zou, Wenli (2021년 9월 23일). 《Stable copernicium hexafluoride (CnF6) with an oxidation state of VI+》. 《Physical Chemistry Chemical Physics》 2022. 321–325쪽. Bibcode:2021PCCP...24..321H. doi:10.1039/D1CP04360A. PMID 34889909.
- ↑ Seth, Michael; Schwerdtfeger, Peter; Fægri, Knut (1999). 《The chemistry of superheavy elements. III. Theoretical studies on element 113 compounds》. 《Journal of Chemical Physics》 111. 6422–6433쪽. Bibcode:1999JChPh.111.6422S. doi:10.1063/1.480168. hdl:2292/5178. S2CID 41854842.
- ↑ Kelley, Morgan P.; Deblonde, Gauthier J.-P.; Su, Jing; Booth, Corwin H.; Abergel, Rebecca J.; Batista, Enrique R.; Yang, Ping (2018). 《Bond Covalency and Oxidation State of Actinide Ions Complexed with Therapeutic Chelating Agent 3,4,3-LI(1,2-HOPO)》. 《Inorganic Chemistry》 57. 5352–5363쪽. doi:10.1021/acs.inorgchem.8b00345. OSTI 1458511. PMID 29624372.
- ↑ Johansson, B.; Abuja, R.; Eriksson, O. 외 (1995). 《Anomalous fcc crystal structure of thorium metal.》. 《Physical Review Letters》 75. 280–283쪽. Bibcode:1995PhRvL..75..280J. doi:10.1103/PhysRevLett.75.280. PMID 10059654.
- ↑ 가 나 Xu, Wen-Hua; Pyykkö, Pekka (2016년 6월 8일). 《Is the chemistry of lawrencium peculiar》. 《Phys. Chem. Chem. Phys.》 2016. 17351–5쪽. Bibcode:2016PCCP...1817351X. doi:10.1039/c6cp02706g. hdl:10138/224395. PMID 27314425. S2CID 31224634. 2017년 4월 24일에 확인함.
- ↑ 가 나 다 Scerri, p. 354–6
- ↑ Oganessian, Yu.Ts.; Abdullin, F.Sh.; Bailey, P.D.; Benker, D.E.; Bennett, M.E.; Dmitriev, S.N. 외 (2010). 《Synthesis of a new element with atomic number {{{1}}}》. 《Physical Review Letters》 104. 142502쪽. Bibcode:2010PhRvL.104n2502O. doi:10.1103/PhysRevLett.104.142502. PMID 20481935. S2CID 3263480.
- ↑ Oganessian, Yu. T. 외 (2002). 《Results from the first 249Cf+48Ca experiment》 (PDF). 《JINR Communication》. 2004년 12월 13일에 원본 문서 (PDF)에서 보존된 문서. 2009년 6월 13일에 확인함.
- ↑ 가 나 “IUPAC Announces the Names of the Elements 113, 115, 117, and 118”. 《IUPAC》. 2016년 11월 30일. 2016년 11월 30일에 원본 문서에서 보존된 문서. 2016년 12월 1일에 확인함.
- ↑ 미국 국립표준기술연구소 (NIST) (August 2019). 《Periodic Table of the Elements》. 《NIST》. 2021년 2월 8일에 원본 문서에서 보존된 문서. 2021년 2월 7일에 확인함.
- ↑ Fricke, B. (1975). Dunitz, J. D. (편집). 《Superheavy elements a prediction of their chemical and physical properties》. 《Structure and Bonding》 21 (Berlin: Springer-Verlag). 89–144쪽. doi:10.1007/BFb0116496. ISBN 978-3-540-07109-9.
- ↑ 가 나 다 Lemonick, Sam (2019). “The periodic table is an icon. But chemists still can't agree on how to arrange it”. 《C&EN News》. 2021년 1월 28일에 원본 문서에서 보존된 문서. 2020년 12월 16일에 확인함.
- ↑ 가 나 Gray, p. 12
- ↑ 가 나 다 라 마 Vlasov, L.; Trifonov, D. (1970). 《107 Stories About Chemistry》. 번역 Sobolev, D. Mir Publishers. 23–27쪽. ISBN 978-0-8285-5067-3.
- ↑ 가 나 다 라 마 Rayner-Canham, Geoffrey (2020). 《The Periodic Table: Past, Present, Future》. World Scientific. 53–70, 85–102쪽. ISBN 978-981-12-1850-7.
- ↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001), 《Organic Chemistry》 1판, Oxford University Press, ISBN 978-0-19-850346-0
- ↑ Seaborg, G. (1945). 《The chemical and radioactive properties of the heavy elements》. 《Chemical & Engineering News》 23. 2190–93쪽. doi:10.1021/cen-v023n023.p2190.
- ↑ 가 나 Kaesz, Herb; Atkins, Peter (2009). 《A Central Position for Hydrogen in the Periodic Table》. 《Chemistry International》 25. 14쪽. doi:10.1515/ci.2003.25.6.14.
- ↑ 가 나 Greenwood & Earnshaw, throughout the book
- ↑ Scerri, Eric (2004). 《The Placement of Hydrogen in the Periodic Table》. 《Chemistry International》 26. 21–22쪽. doi:10.1515/ci.2004.26.3.21. 2023년 1월 1일에 확인함.
- ↑ 가 나 Thyssen, Pieter; Ceulemans, Arnout (2017). 《Shattered Symmetry: Group Theory from the Eightfold Way to the Periodic Table》. Oxford University Press. 336, 360–381쪽. ISBN 978-0-19-061139-2.
- ↑ Kurushkin, Mikhail (2020). 《Helium's placement in the Periodic Table from a crystal structure viewpoint》. 《IUCrJ》 7. 577–578쪽. Bibcode:2020IUCrJ...7..577K. doi:10.1107/S2052252520007769. PMC 7340260. PMID 32695406. 2021년 10월 19일에 원본 문서에서 보존된 문서. 2020년 6월 19일에 확인함.
- ↑ 가 나 다 라 Scerri, pp. 392−401
- ↑ 가 나 Grochala, Wojciech (2017년 11월 1일). 《On the position of helium and neon in the Periodic Table of Elements》. 《Foundations of Chemistry》 20. 191–207쪽. doi:10.1007/s10698-017-9302-7.
- ↑ Bent Weberg, Libby (2019년 1월 18일). 《"The" periodic table》. 《Chemical & Engineering News》 97. 2020년 2월 1일에 원본 문서에서 보존된 문서. 2020년 3월 27일에 확인함.
- ↑ Grandinetti, Felice (2013년 4월 23일). 《Neon behind the signs》. 《Nature Chemistry》 5. 438쪽. Bibcode:2013NatCh...5..438G. doi:10.1038/nchem.1631. PMID 23609097.
- ↑ 가 나 다 라 마 바 Siekierski and Burgess, pp. 23–26
- ↑ Siekierski and Burgess, p. 128
- ↑ Lewars, Errol G. ( 5 December 2008). 《Modeling Marvels: Computational Anticipation of Novel Molecules》. Springer Science & Business Media. 69–71쪽. ISBN 978-1-4020-6973-4. 19 May 2016에 원본 문서에서 보존된 문서.
- ↑ 가 나 Wulfsberg, p. 53: "W. B. Jensen이 지적했듯이, 루테튬은 란타넘보다 이트륨과의 야금학적 유사성이 훨씬 더 강하므로, 우리는 스칸듐과 이트륨 아래에 루테튬(그리고 확장하여 로렌슘)을 나열하는 야금학자의 관례를 채택했다. 이 방식의 중요한 추가적인 이점은 주기율표가 더 대칭적으로 되고, 전자 배열을 예측하기가 더 쉬워진다는 것이다. 에릭 R. 스케리(E. R. Scerri)는 대부분의 f-구역 원소에 대한 최근의 전자 배열 결정이 이제 루테튬과 로렌슘의 이러한 배치와 더 잘 호환된다고 지적한다."
- ↑ 가 나 Kondō, Jun (January 1963). 《Superconductivity in Transition Metals》. 《Progress of Theoretical Physics》 29. 1–9쪽. Bibcode:1963PThPh..29....1K. doi:10.1143/PTP.29.1.
- ↑ Barber, Robert C.; Karol, Paul J; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich W. (2011). 《Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)》. 《Pure Appl. Chem.》 83. 1485쪽. doi:10.1351/PAC-REP-10-05-01.
- ↑ Karol, Paul J.; Barber, Robert C.; Sherrill, Bradley M.; Vardaci, Emanuele; Yamazaki, Toshimitsu (2015년 12월 22일). 《Discovery of the elements with atomic numbers Z = 113, 115 and 117 (IUPAC Technical Report)》. 《Pure Appl. Chem.》 88. 139–153쪽. doi:10.1515/pac-2015-0502.
- ↑ Pyykkö, Pekka (2019). 《An essay on periodic tables》 (PDF). 《Pure and Applied Chemistry》 91. 1959–1967쪽. doi:10.1515/pac-2019-0801. S2CID 203944816. 2022년 11월 27일에 확인함.
- ↑ 가 나 다 라 마 Smits, Odile R.; Düllmann, Christoph E.; Indelicato, Paul; Witold; Schwerdtf5=Peter (2023). 《The quest for superheavy elements and the limit of the periodic table》. 《Nature Reviews Physics》 6. 86–98쪽. doi:10.1038/s42254-023-00668-y. OSTI 2315603. S2CID 266276980.
- ↑ Leigh, G. Jeffrey (2009). 《Periodic Tables and IUPAC》. 《Chemistry International》 31. 4–6쪽. doi:10.1515/ci.2009.31.1.4. 2024년 1월 8일에 확인함.
- ↑ Leigh, G. Jeffrey 편집 (1990). 《Nomenclature of inorganic chemistry : recommendations 1990》. Blackwell Scientific Publications. 283쪽. ISBN 0-632-02319-8.
- ↑ Vernon, R (2021). 《The location and composition of Group 3 of the periodic table》. 《Foundations of Chemistry》 23. 155–197쪽. doi:10.1007/s10698-020-09384-2. S2CID 254501533.
- ↑ Cotton, SA; Raithby, BR; Shield, A (2022). 《A comparison of the structural chemistry of scandium, yttrium, lanthanum and lutetium: A contribution to the group 3 debate》 (PDF). 《Coordination Chemistry Reviews》 455. 214366쪽. doi:10.1016/j.ccr.2021.214366. S2CID 245712597.
- ↑ Lavelle, Laurence (2008). 《Lanthanum (La) and Actinium (Ac) Should Remain in the d-block》. 《Journal of Chemical Education》 85. 1482–1483쪽. Bibcode:2008JChEd..85.1482L. doi:10.1021/ed085p1482.
- ↑ 가 나 다 라 마 바 사 Johnson, David (1984). 《The Periodic Law》 (PDF). The Royal Society of Chemistry. ISBN 0-85186-428-7.
- ↑ Wittig, Jörg (1973). 〈The pressure variable in solid state physics: What about 4f-band superconductors?〉. H. J. Queisser (편집). 《Festkörper Probleme: Plenary Lectures of the Divisions Semiconductor Physics, Surface Physics, Low Temperature Physics, High Polymers, Thermodynamics and Statistical Mechanics, of the German Physical Society, Münster, March 19–24, 1973》. Advances in Solid State Physics 13. Berlin, Heidelberg: Springer. 375–396쪽. doi:10.1007/BFb0108579. ISBN 978-3-528-08019-8.
- ↑ 가 나 Wulfsberg, p. 26
- ↑ 가 나 다 라 마 Greenwood and Earnshaw, pp. 27–9
- ↑ Messler, R. W. (2010). 《The essence of materials for engineers》. Sudbury, MA: Jones & Bartlett Publishers. 32쪽. ISBN 978-0-7637-7833-0.
- ↑ Myers, R. (2003). 《The basics of chemistry》. Westport, CT: Greenwood Publishing Group. 61–67쪽. ISBN 978-0-313-31664-7.
- ↑ Chang, R. (2002). 《Chemistry》 7판. New York: McGraw-Hill. 289–310, 340–42쪽. ISBN 978-0-07-112072-2.
- ↑ Haas, Arthur Erich (1884–1941) Uber die elektrodynamische Bedeutung des Planckschen Strahlungsgesetzes und uber eine neue Bestimmung des elektrischen Elementarquantums und der dimension des wasserstoffatoms. Sitzungsberichte der kaiserlichen Akademie der Wissenschaften in Wien. 2a, 119 pp 119–144 (1910). Haas AE. Die Entwicklungsgeschichte des Satzes von der Erhaltung der Kraft. Habilitation Thesis, Vienna, 1909. Hermann, A. Arthur Erich Haas, Der erste Quantenansatz für das Atom. Stuttgart, 1965 [contains a reprint]
- ↑ 가 나 Clark, Jim (2012). “Atomic and Ionic Radius”. 《Chemguide》. 2020년 11월 14일에 원본 문서에서 보존된 문서. 2021년 3월 30일에 확인함.
- ↑ Cao, Chang-Su; Hu, Han-Shi; Li, Jun; Schwarz, W. H. Eugen (2019). 《Physical origin of chemical periodicities in the system of elements》. 《Pure and Applied Chemistry》 91. 1969–1999쪽. doi:10.1515/pac-2019-0901. S2CID 208868546.
- ↑ Kaupp, Martin (2006년 12월 1일). 《The role of radial nodes of atomic orbitals for chemical bonding and the periodic table》. 《Journal of Computational Chemistry》 28. 320–25쪽. doi:10.1002/jcc.20522. PMID 17143872. S2CID 12677737.
- ↑ 가 나 다 라 Scerri, pp. 407–420
- ↑ Greenwood and Earnshaw, p. 29
- ↑ Imyanitov, Naum S. (2018). 《Is the periodic table appears doubled? Two variants of division of elements into two subsets. Internal and secondary periodicity》. 《Foundations of Chemistry》 21. 255–284쪽. doi:10.1007/s10698-018-9321-z. S2CID 254514910.
- ↑ Chistyakov, V. M. (1968). 《Biron's Secondary Periodicity of the Side d-subgroups of Mendeleev's Short Table》. 《Journal of General Chemistry of the USSR》 38. 213–214쪽. 2024년 1월 6일에 확인함.
- ↑ P. Pyykkö; M. Atsumi (2009). 《Molecular Single-Bond Covalent Radii for Elements 1-118》. 《Chemistry: A European Journal》 15. 186–197쪽. doi:10.1002/chem.200800987. PMID 19058281.
- ↑ 가 나 Pyykkö, Pekka; Desclaux, Jean Paul (1979). 《Relativity and the periodic system of elements》. 《Accounts of Chemical Research》 12. 276쪽. doi:10.1021/ar50140a002.
- ↑ Norrby, Lars J. (1991). 《Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks?》. 《Journal of Chemical Education》 68. 110쪽. Bibcode:1991JChEd..68..110N. doi:10.1021/ed068p110.
- ↑ 가 나 다 라 마 바 Fricke, Burkhard; Waber, J. T. (1971). 《Theoretical Predictions of the Chemistry of Superheavy Elements: Continuation of the Periodic Table up to Z=184》 (PDF). 《Actinides Reviews》 1. 433–485쪽. 2024년 1월 5일에 확인함.
- ↑ Schädel, M. (2003). 《The Chemistry of Superheavy Elements》. Dordrecht: Kluwer Academic Publishers. 277쪽. ISBN 978-1-4020-1250-1.
- ↑ Yakushev, A.; Khuyagbaatar, J.; Düllmann, Ch. E.; Block, M.; Cantemir, R. A.; Cox, D. M.; Dietzel, D.; Giacoppo, F.; Hrabar, Y.; Iliaš, M.; Jäger, E.; Krier, J.; Krupp, D.; Kurz, N.; Lens, L.; Löchner, S.; Mokry, Ch.; Mošať, P.; Pershina, V.; Raeder, S.; Rudolph, D.; Runke, J.; Sarmiento, L. G.; Schausten, B.; Scherer, U.; Thörle-Pospiesch, P.; Trautmann, N.; Wegrzecki, M.; Wieczorek, P. (2024년 9월 23일). 《Manifestation of relativistic effects in the chemical properties of nihonium and moscovium revealed by gas chromatography studies》. 《Frontiers in Chemistry》 12. Bibcode:2024FrCh...1274820Y. doi:10.3389/fchem.2024.1474820. PMC 11464923
|pmc=값 확인 필요 (도움말). PMID 39391836. - ↑ Wulfsberg, pp. 33–34
- ↑ Greenwood and Earnshaw, pp. 24–5
- ↑ 가 나 Clark, Jim (2016). “Ionisation Energy”. 《Chemguide》. 2021년 4월 22일에 원본 문서에서 보존된 문서. 2021년 3월 30일에 확인함.
- ↑ 가 나 Clark, Jim (2012). “Electron Affinity”. 《Chemguide》. 2021년 4월 23일에 원본 문서에서 보존된 문서. 2021년 3월 30일에 확인함.
- ↑ Cárdenas, Carlos; Ayers, Paul; De Proft, Frank; Tozer, David J.; Geerlings, Paul (2010). 《Should negative electron affinities be used for evaluating the chemical hardness?》. 《Physical Chemistry Chemical Physics》 13. 2285–2293쪽. doi:10.1039/C0CP01785J. PMID 21113528.
- ↑ Schmidt, H. T.; Reinhed, P.; Orbán, A.; Rosén, S.; Thomas, R. D.; Johansson, H. A. B.; Werner, J.; Misra, D.; Björkhage, M.; Brännholm, L.; Löfgren, P.; Liljeby, L.; Cederquist, H. (2012). 《The lifetime of the helium anion》. 《Journal of Physics: Conference Series》 388. 012006쪽. Bibcode:2012JPhCS.388a2006S. doi:10.1088/1742-6596/388/1/012006.
- ↑ Wulfsberg, p. 28
- ↑ Wulfsberg, p. 274
- ↑ Greenwood and Earnshaw, p. 113
- ↑ 가 나 다 Siekierski and Burgess, pp. 45–54
- ↑ Amador, J.; Puebla, E. Gutierrez; Monge, M. A.; Rasines, I.; Valero, C. Ruiz (1988). 《Diantimony Tetraoxides Revisited》. 《Inorganic Chemistry》 27. 1367–1370쪽. doi:10.1021/ic00281a011.
- ↑ 가 나 다 Siekierski and Burgess, pp. 134–137
- ↑ 가 나 Siekierski and Burgess, pp. 178–180
- ↑ 가 나 Scerri, pp. 14–15
- ↑ 가 나 다 라 Greenwood and Earnshaw, pp. 25–6
- ↑ Allen, Leland C. (1989). 《Electronegativity is the average one-electron energy of the valence-shell electrons in ground-state free atoms》. 《Journal of the American Chemical Society》 111. 9003–9014쪽. Bibcode:1989JAChS.111.9003A. doi:10.1021/ja00207a003.
- ↑ Dieter, R. K.; Watson, R. T. (2009). 〈Transmetalation reactions producing organocopper compounds〉. Rappoport, Z.; Marek, I. (편집). 《The Chemistry of Organocopper Compounds》 1. John Wiley & Sons. 443–526쪽. ISBN 978-0-470-77296-6. 2022년 10월 17일에 원본 문서에서 보존된 문서. 2022년 4월 6일에 확인함.
- ↑ Carrasco, Rigo A.; Zamarripa, Cesy M.; Zollner, Stefan; Menéndez, José; Chastang, Stephanie A.; Duan, Jinsong; Grzybowski, Gordon J.; Claflin, Bruce B.; Kiefer, Arnold M. (2018). 《The direct bandgap of gray α-tin investigated by infrared ellipsometry》. 《Applied Physics Letters》 113. 232104쪽. Bibcode:2018ApPhL.113w2104C. doi:10.1063/1.5053884. S2CID 125130534.
- ↑ “Intermolecular bonding – van der Waals forces”. 2022년 1월 22일에 원본 문서에서 보존된 문서. 2021년 11월 17일에 확인함.
- ↑ Clark, Jim (2019). “Metallic Bonding”. 《Chemguide》. 2021년 4월 21일에 원본 문서에서 보존된 문서. 2021년 3월 30일에 확인함.
- ↑ Pastor, G. M.; Stampfli, P.; Bennemann, K. (1988). 《On the transition from Van der Waals- to metallic bonding in Hg-clusters as a function of cluster size》. 《Physica Scripta》 38. 623–626쪽. Bibcode:1988PhyS...38..623P. doi:10.1088/0031-8949/38/4/022. S2CID 250842014.
- ↑ 가 나 다 라 마 바 사 Siekierski and Burgess, pp. 60–66
- ↑ 가 나 다 라 Steudel, Ralf; Scheschkewitz, David (2020). 《Chemistry of the Non-Metals》. Walter de Gruyter. 154–155, 425, 436쪽. ISBN 978-3-11-057805-8.
In Group 15 of the Periodic Table, as in both neighboring groups, the metallic character increases when going down. More specifically, there is a transition from a purely non-metallic element (N) via elements with nonmetallic and metallic modifications to purely metallic elements (Sb, Bi). This chapter addresses the two elements besides nitrogen, which are clearly nonmetallic under standard conditions: phosphorus and arsenic. The chemistry of arsenic, however, is only briefly described as many of the arsenic compounds resemble the corresponding phosphorus species.
- ↑ McMinis, J.; Clay, R.C.; Lee, D.; Morales, M.A. (2015). 《Molecular to Atomic Phase Transition in Hydrogen under High Pressure》. 《Phys. Rev. Lett.》 114. 105305쪽. Bibcode:2015PhRvL.114j5305M. doi:10.1103/PhysRevLett.114.105305. PMID 25815944.
- ↑ Hawkes, Stephen J. (2001). 《Semimetallicity?》. 《Journal of Chemical Education》 78. 1686쪽. Bibcode:2001JChEd..78.1686H. doi:10.1021/ed078p1686.
- ↑ Mewes, Jan-Michael; Odile Rosette; Jerabek, Paul; Schwerdtfeger, Peter (2019년 7월 25일). 《Oganesson is a Semiconductor: On the Relativistic Band-Gap Narrowing in the Heaviest Noble-Gas Solids》. 《Angewandte Chemie》 58. 14260–14264쪽. doi:10.1002/anie.201908327. PMC 6790653. PMID 31343819.
- ↑ Smith, J. D. (1973). 《The Chemistry of Arsenic, Antimony and Bismuth》. Pergamon Press. 556쪽.
- ↑ Rayner-Canham, Geoff; Overton, Tina (2008). 《Descriptive Inorganic Chemistry》 5판. New York: W. H. Freeman and Company. 194쪽. ISBN 978-1-4292-2434-5.
- ↑ 가 나 Mewes, J.-M.; Smits, O. R.; Kresse, G.; Schwerdtfeger, P. (2019). 《Copernicium is a Relativistic Noble Liquid》. 《Angewandte Chemie International Edition》 58. 17964–17968쪽. doi:10.1002/anie.201906966. PMC 6916354. PMID 31596013.
- ↑ 가 나 Florez, Edison; Smits, Odile R.; Mewes, Jan-Michael; Jerabek, Paul; Schwerdtfeger, Peter (2022). 《From the gas phase to the solid state: The chemical bonding in the superheavy element flerovium》. 《The Journal of Chemical Physics》 157. 064304쪽. Bibcode:2022JChPh.157f4304F. doi:10.1063/5.0097642. PMID 35963734. S2CID 250539378.
- ↑ 가 나 Gäggeler, H. W. (2007). “Gas Phase Chemistry of Superheavy Elements” (PDF). 파울 쉐러 연구소. 26–28쪽. 2012년 2월 20일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ 가 나 Ingo, Peter (2022년 9월 15일). “Study shows flerovium is the most volatile metal in the periodic table”. 《phys.org》. 2022년 11월 22일에 확인함.
- ↑ 가 나 Yakushev, A.; Lens, L.; Düllmann, Ch. E. 외 (2022년 8월 25일). 《On the adsorption and reactivity of element 114, flerovium》. 《Frontiers in Chemistry》 10. 976635쪽. Bibcode:2022FrCh...10.6635Y. doi:10.3389/fchem.2022.976635. PMC 9453156. PMID 36092655.
- ↑ Hermann, A.; Hoffmann, R.; Ashcroft, N. W. (2013). 《Condensed Astatine: Monatomic and Metallic》. 《Physical Review Letters》 111. 116404–1–116404–5쪽. Bibcode:2013PhRvL.111k6404H. doi:10.1103/PhysRevLett.111.116404. PMID 24074111.
- ↑ Ball, Philip (2013년 9월 13일). “Metallic properties predicted for astatine”. 《Chemistry World》. 2023년 4월 7일에 확인함.
- ↑ 가 나 Clark, Jim (2012). “Metallic Structures”. 《Chemguide》. 2021년 4월 24일에 원본 문서에서 보존된 문서. 2021년 3월 30일에 확인함.
- ↑ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). 〈Mangan〉 91–100판 (독일어). 《Lehrbuch der Anorganischen Chemie》. Walter de Gruyter. 1110–1117쪽. ISBN 978-3-11-007511-3.
- ↑ Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). 《Inorganic chemistry》. Academic Press. 758쪽. ISBN 978-0-12-352651-9.
- ↑ Hammond, C. R. (2004). 《The Elements, in Handbook of Chemistry and Physics》 81판. Boca Raton (FL, US): CRC press. 4–1쪽. ISBN 978-0-8493-0485-9.
- ↑ G.V. Samsonov 편집 (1968). 〈Mechanical Properties of the Elements〉. 《Handbook of the Physicochemical Properties of the Elements》. New York, USA: IFI-Plenum. 387–446쪽. doi:10.1007/978-1-4684-6066-7_7. ISBN 978-1-4684-6066-7. 2015년 4월 2일에 원본 문서에서 보존된 문서.
- ↑ Hammer, B.; Norskov, J. K. (1995). 《Why gold is the noblest of all the metals》. 《Nature》 376. 238–240쪽. Bibcode:1995Natur.376..238H. doi:10.1038/376238a0. S2CID 4334587.
- ↑ Johnson, P. B.; Christy, R. W. (1972). 《Optical Constants of the Noble Metals》. 《Physical Review B》 6. 4370–4379쪽. Bibcode:1972PhRvB...6.4370J. doi:10.1103/PhysRevB.6.4370.
- ↑ Clark, Jim (2018). “Atomic and Physical Properties of the Period 3 Elements”. 《Chemguide》. 2021년 4월 22일에 원본 문서에서 보존된 문서. 2021년 3월 30일에 확인함.
- ↑ 가 나 Clark, Jim (2015). “The Trend From Non-Metal to Metal In the Group 4 Elements”. 《Chemguide》. 2021년 4월 27일에 원본 문서에서 보존된 문서. 2021년 3월 30일에 확인함.
- ↑ Wei, Lanhua; Kuo, P. K.; Thomas, R. L.; Anthony, T. R.; Banholzer, W. F. (1993). 《Thermal conductivity of isotopically modified single crystal diamond》. 《Physical Review Letters》 70. 3764–3767쪽. Bibcode:1993PhRvL..70.3764W. doi:10.1103/PhysRevLett.70.3764. PMID 10053956.
- ↑ 가 나 다 라 “Periodic Table of Chemical Elements”. 《www.acs.org》. 미국화학회. 2021. 2021년 2월 3일에 원본 문서에서 보존된 문서. 2021년 3월 27일에 확인함.
- ↑ “Periodic Table”. 《www.rsc.org》. 왕립화학회. 2021. 2021년 3월 21일에 원본 문서에서 보존된 문서. 2021년 3월 27일에 확인함.
- ↑ 가 나 다 라 마 틀:브리태니커 백과사전
- ↑ Sherwin, E.; Weston, G. J. (1966). Spice, J. E. (편집). 《Chemistry of the Non-Metallic Elements》. Pergamon Press. ISBN 978-1-4831-3905-0.
- ↑ 가 나 Hawkes, Stephen J. (2001). 《Semimetallicity?》. 《Journal of Chemical Education》 78. 1686–1687쪽. Bibcode:2001JChEd..78.1686H. doi:10.1021/ed078p1686.
- ↑ 가 나 Jensen, William B. (January–April 1986). 《Classification, symmetry and the periodic table》 (PDF). 《Comp. & Maths. With Appls.》 12. 487–510쪽. doi:10.1016/0898-1221(86)90167-7. 2017년 1월 31일에 원본 문서에서 보존된 문서. 2017년 1월 18일에 확인함.
- ↑ Greenwood and Earnshaw, pp. 29–31
- ↑ Fernelius, W. C.; Loening, Kurt; Adams, Roy M. (1971). 《Names of groups and elements》. 《Journal of Chemical Education》 48. 730–731쪽. Bibcode:1971JChEd..48..730F. doi:10.1021/ed048p730.
- ↑ Jensen, William B. (2003). 《The Place of Zinc, Cadmium, and Mercury in the Periodic Table》 (PDF). 《Journal of Chemical Education》 80. 952–961쪽. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. 2010년 6월 11일에 원본 문서 (PDF)에서 보존된 문서. 2012년 5월 6일에 확인함.
- ↑ Leigh, G. J. 편집 (2011). 《Principles of Chemical Nomenclature》 (PDF). The Royal Society of Chemistry. 9쪽. ISBN 978-1-84973-007-5.
- ↑ Winter, Mark (1993–2022). “WebElements”. The University of Sheffield and WebElements Ltd, UK. 2022년 12월 5일에 확인함.
- ↑ Cowan, Robert D. (1981). 《The Theory of Atomic Structure and Spectra》. University of California Press. 598쪽. ISBN 978-0-520-90615-0.
- ↑ Villar, G. E. (1966). 《A suggested modification to the periodic chart》. 《Journal of Inorganic and Nuclear Chemistry》 28. 25–29쪽. doi:10.1016/0022-1902(66)80224-5.
- ↑ 가 나 Cotton, S. A. (1996). 《After the actinides, then what?》. 《Chemical Society Reviews》 25. 219–227쪽. doi:10.1039/CS9962500219.
- ↑ Neve, Francesco (2022). 《Chemistry of superheavy transition metals》. 《Journal of Coordination Chemistry》 75. 2287–2307쪽. doi:10.1080/00958972.2022.2084394. S2CID 254097024.
- ↑ Mingos, Michael (1998). 《Essential Trends in Inorganic Chemistry》. Oxford University Press. 387쪽. ISBN 978-0-19-850109-1.
- ↑ “A New Era of Discovery: the 2023 Long Range Plan for Nuclear Science” (PDF). U.S. Department of Energy. October 2023. 2023년 10월 5일에 원본 문서 (PDF)에서 보존된 문서. 2023년 10월 20일에 확인함 – OSTI 경유.
Superheavy elements (Z > 102) are teetering at the limits of mass and charge.
- ↑ Kragh, Helge (2017). “The search for superheavy elements: Historical and philosophical perspectives”. arXiv:1708.04064 [physics.hist-ph].
- ↑ Theuns, Tom. “Metallicity of stars”. 《icc.dur.ac.uk》. Durham University. 2021년 9월 27일에 원본 문서에서 보존된 문서. 2021년 3월 27일에 확인함.
- ↑ Burns, Gerald (1985). 《Solid State Physics》. Academic Press, Inc. 339–40쪽. ISBN 978-0-12-146070-9.
- ↑ Duffus, John H. (2002). 《"Heavy Metals"–A Meaningless Term?》 (PDF). 《Pure and Applied Chemistry》 74. 793–807쪽. doi:10.1351/pac200274050793. S2CID 46602106. 2021년 4월 11일에 원본 문서 (PDF)에서 보존된 문서. 2021년 3월 27일에 확인함.
- ↑ Koppenol, W. (2016). 《How to name new chemical elements》 (PDF). 《Pure and Applied Chemistry》 (DeGruyter). doi:10.1515/pac-2015-0802. hdl:10045/55935. S2CID 102245448. 2020년 5월 11일에 원본 문서 (PDF)에서 보존된 문서. 2021년 8월 15일에 확인함.
- ↑ Roth, Klaus (2018년 4월 3일). 《Is Element 118 a Noble Gas?》. 《Chemie in unserer Zeit》. doi:10.1002/chemv.201800029. 2021년 3월 2일에 원본 문서에서 보존된 문서. 2021년 3월 27일에 확인함.
- ↑ 일본 화학회 (2018년 1월 25일). “【お知らせ】高等学校化学で用いる用語に関する提案(1)への反応”. 《www.chemistry.or.jp》. 일본 화학회. 2021년 5월 16일에 원본 문서에서 보존된 문서. 2021년 4월 3일에 확인함.
「12.アルカリ土類金属」の範囲についても,△を含めれば,すべての教科書で提案が考慮されている。歴史的には第4 周期のカルシウム以下を指していた用語だったが,「周期表の2 族に対応する用語とする」というIUPAC の勧告1)に従うのは現在では自然な流れだろう。
- ↑ Wurzer, Ferdinand (1817). 《Auszug eines Briefes vom Hofrath Wurzer, Prof. der Chemie zu Marburg》 [Excerpt of a letter from Court Advisor Wurzer, Professor of Chemistry at Marburg] (독일어). 《Annalen der Physik》 56. 331–334쪽. Bibcode:1817AnP....56..331.. doi:10.1002/andp.18170560709. 2021년 10월 8일에 원본 문서에서 보존된 문서. 2021년 8월 15일에 확인함. 여기서 되베라이너는 스트론튬의 성질이 칼슘과 바륨의 중간이라는 것을 발견했다.
- ↑ Döbereiner, J. W. (1829). 《Versuch zu einer Gruppirung der elementaren Stoffe nach ihrer Analogie》 [An attempt to group elementary substances according to their analogies] (독일어). 《Annalen der Physik und Chemie》. 2nd series 15. 301–307쪽. Bibcode:1829AnP....91..301D. doi:10.1002/andp.18290910217. 2021년 10월 8일에 원본 문서에서 보존된 문서. 2021년 8월 15일에 확인함. 이 기사의 영어 번역은 다음을 참조하시오: Johann Wolfgang Döbereiner: "An Attempt to Group Elementary Substances according to Their Analogies" (Lemoyne College (Syracuse, New York, USA)) 보관됨 9 3월 2019 - 웨이백 머신
- ↑ Horvitz, L. (2002). 《Eureka!: Scientific Breakthroughs That Changed The World》. New York: John Wiley. 43쪽. Bibcode:2001esbt.book.....H. ISBN 978-0-471-23341-1. OCLC 50766822.
- ↑ Scerri, p. 47
- ↑ Ball, P. (2002). 《The Ingredients: A Guided Tour of the Elements》. Oxford: Oxford University Press. 100쪽. ISBN 978-0-19-284100-1.
- ↑ 가 나 틀:브리태니커 백과사전 제11판 인용
- ↑ Meyer, Julius Lothar; Die modernen Theorien der Chemie (1864); table on page 137 보관됨 2 1월 2019 - 웨이백 머신
- ↑ Scerri, pp. 106–108
- ↑ Scerri, p. 113
- ↑ 가 나 Scerri, pp. 117–123
- ↑ Mendeleev, D. (1871). 《The natural system of elements and its application to the indication of the properties of undiscovered elements》 (러시아어). 《Journal of the Russian Chemical Society》 3. 25–56쪽. 2017년 8월 13일에 원본 문서에서 보존된 문서. 2017년 8월 23일에 확인함.
- ↑ Scerri, p. 149
- ↑ Scerri, p. 151–2
- ↑ Rouvray, R. “Dmitri Mendeleev” (미국 영어). 《New Scientist》. 2021년 8월 15일에 원본 문서에서 보존된 문서. 2020년 4월 19일에 확인함.
- ↑ Scerri, pp. 164–169
- ↑ 가 나 다 Marshall, J.L.; Marshall, V.R. (2010). “Rediscovery of the Elements: Moseley and Atomic Numbers” (PDF). 《The Hexagon》. 101권 3호 (Alpha Chi Sigma). 42–47쪽. S2CID 94398490. 2019년 7월 16일에 원본 문서 (PDF)에서 보존된 문서. 2021년 8월 15일에 확인함.
- ↑ A. van den Broek, Physikalische Zeitschrift, 14, (1913), 32–41
- ↑ Scerri, p. 185
- ↑ A. van den Broek, Die Radioelemente, das periodische System und die Konstitution der Atom, Physik. Zeitsch., 14, 32, (1913).
- ↑ E. Rutherford, Phil. Mag., 27, 488–499 (Mar. 1914). "This has led to an interesting suggestion by van Broek that the number of units of charge on the nucleus, and consequently the number of external electrons, may be equal to the number of the elements when arranged in order of increasing atomic weight. On this view, the nucleus charges of hydrogen, helium, and carbon are 1, 2, 6 respectively, and so on for the other elements, provided there is no gap due to a missing element. This view has been taken by Bohr in his theory of the constitution of simple atoms and molecules."
- ↑ Atkins, P. W. (1995). 《The Periodic Kingdom》. HarperCollins Publishers, Inc. 87쪽. ISBN 978-0-465-07265-1.
- ↑ Egdell, Russell G.; Bruton, Elizabeth (2020). 《Henry Moseley, X-ray spectroscopy and the periodic table》. 《Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences》 378. doi:10.1002/chem.202004775. PMID 32811359.
- ↑ Hisamatsu, Yoji; Egashira, Kazuhiro; Maeno, Yoshiteru (2022). 《Ogawa's nipponium and its re-assignment to rhenium》. 《Foundations of Chemistry》 24. 15–57쪽. doi:10.1007/s10698-021-09410-x.
- ↑ 가 나 다 Scerri, Eric (2013). 《A Tale of Seven Elements》. Oxford University Press. 47–53, 115쪽. ISBN 978-0-19-539131-2.
- ↑ 아래 1913년 논문의 보어 표 참조.
- ↑ Helge Kragh, Aarhus, Lars Vegard, Atomic Structure, and the Periodic System, Bull. Hist. Chem., VOLUME 37, Number 1 (2012), p.43.
- ↑ Scerri, pp. 208–218
- ↑ Niels Bohr, "On the Constitution of Atoms and Molecules, Part III, Systems containing several nuclei" Philosophical Magazine 26:857--875 (1913)
- ↑ Kragh, Helge (1979년 1월 1일). 《Niels Bohr's Second Atomic Theory》 (영어). 《Historical Studies in the Physical Sciences》 10. 123–186쪽. doi:10.2307/27757389. ISSN 0073-2672. JSTOR 27757389.
- ↑ W. Kossel, "Über Molekülbildung als Folge des Atom- baues", Ann. Phys., 1916, 49, 229–362 (237).
- ↑ Translated in Helge Kragh, Aarhus, Lars Vegard, Atomic Structure, and the Periodic System, Bull. Hist. Chem., VOLUME 37, Number 1 (2012), p.43.
- ↑ Langmuir, Irving (June 1919). 《The Arrangement of Electrons in Atoms and Molecules》 (영어). 《미국 화학회지》 41. 868–934쪽. Bibcode:1919JAChS..41..868L. doi:10.1021/ja02227a002. ISSN 0002-7863. 2021년 1월 26일에 원본 문서에서 보존된 문서. 2021년 10월 22일에 확인함.
- ↑ 가 나 Bury, Charles R. (July 1921). 《Langmuir's Theory of the Arrangement of Electrons in Atoms and Molecules》 (영어). 《미국 화학회지》 43. 1602–1609쪽. Bibcode:1921JAChS..43.1602B. doi:10.1021/ja01440a023. ISSN 0002-7863. 2021년 10월 30일에 원본 문서에서 보존된 문서. 2021년 10월 22일에 확인함.
- ↑ Jensen, William B. (2003). 《The Place of Zinc, Cadmium, and Mercury in the Periodic Table》 (PDF). 《Journal of Chemical Education》 80. 952–961쪽. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. 2012년 4월 19일에 원본 문서 (PDF)에서 보존된 문서. 2021년 9월 18일에 확인함.
원자 내 전자 구조와 주기율표에 대한 1921년 논문에서 영국 화학자 C. R.Bury가 처음으로 "transition"이라는 용어를 현대적 전자적 의미로 사용한 것으로 보인다.
- ↑ Coster, D.; Hevesy, G. (1923). 《On the Missing Element of Atomic Number 72》. 《네이처 (저널)》 111. 79쪽. Bibcode:1923Natur.111...79C. doi:10.1038/111079a0.
- ↑ Fernelius, W. C. (1982). 《Hafnium》 (PDF). 《화학 교육 저널》 59. 242쪽. Bibcode:1982JChEd..59..242F. doi:10.1021/ed059p242. 2020년 3월 15일에 원본 문서 (PDF)에서 보존된 문서. 2009년 9월 3일에 확인함.
- ↑ Burdette, Shawn C.; Thornton, Brett F. (2018). 《Hafnium the lutécium I used to be》. 《Nature Chemistry》 10. 1074쪽. Bibcode:2018NatCh..10.1074B. doi:10.1038/s41557-018-0140-6. PMID 30237529. 2024년 2월 8일에 확인함.
- ↑ Scerri, pp. 218–23
- ↑ Jensen, William B. (2007). 《The Origin of the s, p, d, f Orbital Labels》 (PDF). 《Journal of Chemical Education》 84. 757–8쪽. Bibcode:2007JChEd..84..757J. doi:10.1021/ed084p757. 2018년 11월 23일에 원본 문서 (PDF)에서 보존된 문서. 2021년 8월 15일에 확인함.
- ↑ Karapetoff, Vladimir (1930). 《A chart of consecutive sets of electronic orbits within atoms of chemical elements》. 《Journal of the Franklin Institute》 210. 609–624쪽. doi:10.1016/S0016-0032(30)91131-3.
- ↑ Ostrovsky, Valentin N. (2003). 《Physical Explanation of the Periodic Table》. 《Annals of the New York Academy of Sciences》 988. 182–192쪽. Bibcode:2003NYASA.988..182O. doi:10.1111/j.1749-6632.2003.tb06097.x. PMID 12796101. S2CID 21629328.
- ↑ Klechkovskii, V.M. (1962). 《Justification of the Rule for Successive Filling of (n+l) Groups》. 《Journal of Experimental and Theoretical Physics》 14. 334쪽. 2022년 6월 23일에 확인함.
- ↑ 가 나 Demkov, Yury N.; Ostrovsky, Valentin N. (1972). 《n+l Filling Rule in the Periodic System and Focusing Potentials》. 《Journal of Experimental and Theoretical Physics》 35. 66–69쪽. Bibcode:1972JETP...35...66D. 2022년 11월 25일에 확인함.
- ↑ Jørgensen, Christian Klixbüll (1988). 〈Influence of Rare Earths on Chemical Understanding and Classification〉. Gschneidner Jr., Karl A.; Eyring, Leroy (편집). 《Handbook on the Physics and Chemistry of Rare Earths》 11. Elsevier. 197–292쪽. ISBN 978-0-444-87080-3.
- ↑ Scerri, pp. 313–321
- ↑ Scerri, pp. 322–340
- ↑ 가 나 Seaborg, Glenn T. (1997). “Source of the Actinide Concept” (PDF). 《fas.org》. Los Alamos National Laboratory. 2021년 8월 15일에 원본 문서 (PDF)에서 보존된 문서. 2021년 3월 28일에 확인함.
- ↑ Scerri, pp. 356–9
- ↑ Öhrström, Lars; Holden, Norman E. (2016). 《The Three-letter Element Symbols》. 《Chemistry International》 38. 4–8쪽. doi:10.1515/ci-2016-0204. S2CID 124737708.
- ↑ Wapstra, A. H. (1991). 《Criteria that must be satisfied for the discovery of a new chemical element to be recognized》. 《Pure and Applied Chemistry》 63. 879–886쪽. doi:10.1351/pac199163060879. S2CID 95737691. 2022년 10월 18일에 확인함.
- ↑ 《Names and symbols of transfermium elements (IUPAC Recommendations 1997)》. 《Pure and Applied Chemistry》 69. 1997. 2471–2474쪽. doi:10.1351/pac199769122471.
- ↑ Hofmann, Sigurd (2019). 《Criteria for New Element Discovery》. 《Chemistry International》 41. 10–15쪽. doi:10.1515/ci-2019-0103.
- ↑ Scerri, E. (2012). 《Mendeleev's Periodic Table Is Finally Completed and What To Do about Group 3?》. 《Chemistry International》 34. doi:10.1515/ci.2012.34.4.28. 2017년 7월 5일에 원본 문서에서 보존된 문서.
- ↑ Scerri, pp. 356–363
- ↑ 가 나 Chapman, Kit (2016년 11월 30일). 《What it takes to make a new element》. 《화학 세계》 (왕립화학회). 2017년 10월 28일에 원본 문서에서 보존된 문서. 2022년 3월 22일에 확인함.
- ↑ Briggs, Helen (2019년 1월 29일). “150 years of the periodic table: Test your knowledge” (영국 영어). 2019년 2월 9일에 원본 문서에서 보존된 문서. 2019년 2월 8일에 확인함.
- ↑ Hofmann, Sigurd; Dmitriev, Sergey N.; Fahlander, Claes; Gates, Jacklyn M.; Roberto, James B.; Sakai, Hideyuki (2020년 8월 4일). 《On the discovery of new elements (IUPAC/IUPAP Report)》. 《Pure and Applied Chemistry》 92. 1387–1446쪽. doi:10.1515/pac-2020-2926. S2CID 225377737.
- ↑ 가 나 Fricke, Burkhard (1975). 《Superheavy elements: a prediction of their chemical and physical properties》. 《Recent Impact of Physics on Inorganic Chemistry》. Structure and Bonding 21. 89–144쪽. doi:10.1007/BFb0116498. ISBN 978-3-540-07109-9. 2013년 10월 4일에 확인함.
- ↑ 가 나 다 Fricke, Burkhard (1977). 《Dirac–Fock–Slater calculations for the elements Z = 100, fermium, to Z = 173》 (PDF). 《Recent Impact of Physics on Inorganic Chemistry》 19. 83–192쪽. Bibcode:1977ADNDT..19...83F. doi:10.1016/0092-640X(77)90010-9. 2016년 3월 22일에 원본 문서 (PDF)에서 보존된 문서. 2016년 2월 25일에 확인함.
- ↑ 가 나 Ball, P. (2019). 《Extreme chemistry: experiments at the edge of the periodic table》. 《Nature》 565. 552–555쪽. Bibcode:2019Natur.565..552B. doi:10.1038/d41586-019-00285-9. ISSN 1476-4687. PMID 30700884.
- ↑ Dmitriev, Sergey; Itkis, Mikhail; Oganessian, Yuri (2016). 《Status and perspectives of the Dubna superheavy element factory》 (PDF). Nobel Symposium NS160 – Chemistry and Physics of Heavy and Superheavy Elements. doi:10.1051/epjconf/201613108001. 2021년 8월 28일에 원본 문서 (PDF)에서 보존된 문서. 2021년 8월 15일에 확인함.
- ↑ Sokolova, Svetlana; Popeko, Andrei (2021년 5월 24일). “How are new chemical elements born?”. 《jinr.ru》. JINR. 2021년 11월 4일에 원본 문서에서 보존된 문서. 2021년 11월 4일에 확인함.
- ↑ Chapman, Kit (2023년 10월 10일). “Berkeley Lab to lead US hunt for element 120 after breakdown of collaboration with Russia”. 《화학 세계》. 2023년 10월 20일에 확인함.
- ↑ Biron, Lauren (2023년 10월 16일). “Berkeley Lab to Test New Approach to Making Superheavy Elements”. 《lbl.gov》. 로런스 버클리 국립연구소. 2023년 10월 20일에 확인함.
- ↑ Gan, Z. G.; Huang, W. X.; Zhang, Z. Y.; Zhou, X. H.; Xu, H. S. (2022). 《Results and perspectives for study of heavy and super-heavy nuclei and elements at IMP/CAS》. 《The European Physical Journal A》 58. Bibcode:2022EPJA...58..158G. doi:10.1140/epja/s10050-022-00811-w.
- ↑ 가 나 Scerri, Eric (2020). 《Recent attempts to change the periodic table》. 《Philosophical Transactions of the Royal Society A》 378. Bibcode:2020RSPTA.37890300S. doi:10.1098/rsta.2019.0300. PMID 32811365. S2CID 221136189.
- ↑ Frazier, K. (1978). 《Superheavy Elements》. 《Science News》 113. 236–38쪽. doi:10.2307/3963006. JSTOR 3963006.
- ↑ 가 나 다 Fricke, B.; Greiner, W.; Waber, J. T. (1971). 《The continuation of the periodic table up to Z = 172. The chemistry of superheavy elements》. 《Theoretica Chimica Acta》 21. 235–60쪽. doi:10.1007/BF01172015. S2CID 117157377.
- ↑ 가 나 Pyykkö, P. (2011). 《A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions》. 《Physical Chemistry Chemical Physics》 13. 161–68쪽. Bibcode:2011PCCP...13..161P. doi:10.1039/c0cp01575j. PMID 20967377. S2CID 31590563.
- ↑ Jerabek, Paul; Schuetrumpf, Bastian; Schwerdtfeger, Peter; Nazarewicz, Witold (2018). 《Electron and Nucleon Localization Functions of Oganesson: Approaching the Thomas-Fermi Limit》. 《Phys. Rev. Lett.》 120. 053001쪽. arXiv:1707.08710. Bibcode:2018PhRvL.120e3001J. doi:10.1103/PhysRevLett.120.053001. PMID 29481184. S2CID 3575243.
- ↑ Wothers, Peter (2019). 《Antimony, Gold, and Jupiter's Wolf》. Oxford University Press. vii쪽. ISBN 978-0-19-965272-3.
- ↑ 가 나 다 Smits, O. R.; Indelicato, P.; Nazarewicz, W.; Piibeleht, M.; Schwerdtfeger, P. (2023). 《Pushing the limits of the periodic table—A review on atomic relativistic electronic structure theory and calculations for the superheavy elements》. 《Physics Reports》 1035. 1–57쪽. arXiv:2301.02553. Bibcode:2023PhR..1035....1S. doi:10.1016/j.physrep.2023.09.004.
- ↑ Pershina, Valeria (2020). 《Relativistic effects on the electronic structure of the heaviest elements. Is the Periodic Table endless?》 (PDF). 《Comptes Rendus Chimie》 23. 255–265쪽. doi:10.5802/crchim.25. S2CID 222225772. 2020년 12월 11일에 원본 문서 (PDF)에서 보존된 문서. 2021년 3월 28일에 확인함.
- ↑ “Superheavy Element 114 Confirmed: A Stepping Stone to the Island of Stability”. 버클리 연구소. 2009. 2019년 7월 20일에 원본 문서에서 보존된 문서. 2019년 10월 23일에 확인함.
- ↑ Oganessian, Yu. Ts. (2012). 《Nuclei in the "Island of Stability" of Superheavy Elements》. 《물리학 저널: 컨퍼런스 시리즈》 337. 012005쪽. Bibcode:2012JPhCS.337a2005O. doi:10.1088/1742-6596/337/1/012005.
- ↑ 가 나 Schwerdtfeger, Peter; Pašteka, Lukáš F.; Punnett, Andrew; Bowman, Patrick O. (2015). 《Relativistic and quantum electrodynamic effects in superheavy elements》. 《Nuclear Physics A》 944. 551–577쪽. Bibcode:2015NuPhA.944..551S. doi:10.1016/j.nuclphysa.2015.02.005.
- ↑ 가 나 Greiner, W. (2013). 《Nuclei: superheavy-superneutronic-strange-and of antimatter》 (PDF). 《Journal of Physics: Conference Series》 413. 012002–1–012002–9쪽. Bibcode:2013JPhCS.413a2002G. doi:10.1088/1742-6596/413/1/012002. 2019년 3월 30일에 원본 문서 (PDF)에서 보존된 문서. 2021년 8월 15일에 확인함.
- ↑ Hofmann, Sigurd (2019). 《Synthesis and properties of isotopes of the transactinides》. 《Radiochimica Acta》 107. 879–915쪽. doi:10.1515/ract-2019-3104. S2CID 203848120.
- ↑ Scerri, p. 386
- ↑ Peter Möller (2016). 《The limits of the nuclear chart set by fission and alpha decay | EPJ Web of Conferences》. 《European Physical Journal Web of Conferences》 131 (Epj-conferences.org). 03002쪽. Bibcode:2016EPJWC.13103002M. doi:10.1051/epjconf/201613103002. 2022년 6월 20일에 원본 문서에서 보존된 문서. 2022년 6월 13일에 확인함.
- ↑ Holdom, B.; Ren, J.; Zhang, C. (2018). 《Quark matter may not be strange》. 《Physical Review Letters》 120. 222001–1–222001–6쪽. arXiv:1707.06610. Bibcode:2018PhRvL.120v2001H. doi:10.1103/PhysRevLett.120.222001. PMID 29906186. S2CID 49216916.
- ↑ Xia, Cheng-Jun; Xue, She-Sheng; Xu, Ren-Xin; Zhou, Shan-Gui (2020). 《Supercritically charged objects and electron-positron pair creation》. 《Physical Review D》 101. 103031쪽. arXiv:2001.03531. Bibcode:2020PhRvD.101j3031X. doi:10.1103/PhysRevD.101.103031. S2CID 210157134.
- ↑ Giuliani, S. A.; Matheson, Z.; Nazarewicz, W.; Olsen, E.; Reinhard, P.-G.; Sadhukhan, J.; Schtruempf, B.; Schunck, N.; Schwerdtfeger, P. (2019). 《Colloquium: Superheavy elements: Oganesson and beyond》. 《Reviews of Modern Physics》 91. 011001–1–011001–25쪽. Bibcode:2019RvMP...91a1001G. doi:10.1103/RevModPhys.91.011001. S2CID 126906074.
- ↑ Giardina, G.; Fazio, G.; Mandaglio, G.; Manganaro, M.; Nasirov, A.K.; Romaniuk, M.V.; Saccà, C. (2010). 《Expectations and limits to synthesize nuclei with Z ≥ 120》. 《International Journal of Modern Physics E》 19. 882–893쪽. Bibcode:2010IJMPE..19..882G. doi:10.1142/S0218301310015333. 2021년 10월 19일에 원본 문서에서 보존된 문서. 2021년 8월 15일에 확인함.
- ↑ Zagrebaev, Valeriy; Karpov, Alexander; Greiner, Walter (2013). 《Future of superheavy element research: Which nuclei could be synthesized within the next few years?》 (PDF). 《Journal of Physics》 420 (IOP Publishing Ltd.). 012001쪽. arXiv:1207.5700. Bibcode:2013JPhCS.420a2001Z. doi:10.1088/1742-6596/420/1/012001. S2CID 55434734. 2015년 10월 3일에 원본 문서 (PDF)에서 보존된 문서. 2020년 12월 1일에 확인함.
- ↑ Subramanian, S. (2019). “Making New Elements Doesn't Pay. Just Ask This Berkeley Scientist”. 《블룸버그 비즈니스위크》. 2019년 12월 11일에 원본 문서에서 보존된 문서. 2020년 1월 18일에 확인함.
- ↑ Scerri, p. 20
- ↑ 《Edward G. Mazurs Collection of Periodic Systems Images》 (Finding Aid). 과학 역사 연구소. 2019년 3월 27일에 원본 문서에서 보존된 문서. 2018년 10월 2일에 확인함. 전체 찾기 도구로 이동하려면 'Finding Aid'를 클릭하시오.
- ↑ Francl, M. (May 2009). 《Table manners》 (PDF). 《Nature Chemistry》 1. 97–98쪽. Bibcode:2009NatCh...1...97F. doi:10.1038/nchem.183. PMID 21378810. 2012년 10월 25일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ 가 나 다 Scerri, pp. 402–3
- ↑ Scerri, Eric (2019년 1월 29일). “Happy sesquicentennial to the periodic table of the elements”. Oxford University Press. 2019년 3월 27일에 원본 문서에서 보존된 문서. 2019년 4월 12일에 확인함.
- ↑ Scerri, p. 255
- ↑ Scerri, ER (2021). 〈The Impact of Twentieth-Century Physics on the Periodic Table and Some Remaining Questions in the Twenty-First Century〉. Giunta, CJ; Mainz, VV; Girolami, GS (편집). 《150 Years of the Periodic Table: Perspectives on the History of Chemistry》. Book Publishers. 409–423 (414)쪽. doi:10.1007/978-3-030-67910-1_16. ISBN 978-3-030-67909-5.
- ↑ Ostrovsky, V. N. (2005). 《On Recent Discussion Concerning Quantum Justification of the Periodic Table of the Elements》. 《Foundations of Chemistry》 7. 235–239쪽. doi:10.1007/s10698-005-2141-y. S2CID 93589189.
- ↑ Scerri, Eric (2012). 《What is an element? What is the periodic table? And what does quantum mechanics contribute to the question?》 (PDF). 《Foundations of Chemistry》 14. 69–81쪽. doi:10.1007/s10698-011-9124-y. S2CID 254503469.
- ↑ Scerri, Eric (2021). 《Various forms of the periodic table including the left-step table, the regularization of atomic number triads and first-member anomalies》. 《ChemTexts》 8. doi:10.1007/s40828-021-00157-8. S2CID 245540088.
참고 문헌
[편집]- Greenwood, Norman N.; Earnshaw, Alan (1997). 《Chemistry of the Elements》 2판. Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). 《General chemistry: principles and modern applications》 8판. Upper Saddle River, N.J.: Prentice Hall. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.
- Siekierski, S.; Burgess, J. (2002). 《Concise Chemistry of the Elements》. Horwood. ISBN 978-1-898563-71-6.
- 스체리, 에릭 R (2020). 주기율표: 그 이야기와 의미 (2판). 옥스퍼드 대학교 출판부, 뉴욕, ISBN 978-0-19-091436-3.
- Wulfsberg, Gary (2000). 《Inorganic Chemistry》. University Science Books. ISBN 9781891389016.
더 읽어보기
[편집]- Calvo, Miguel (2019). 《Construyendo la Tabla Periódica》. Zaragoza, Spain: Prames. 407쪽. ISBN 978-84-8321-908-9.
- Emsley, J. (2011). 〈The Periodic Table〉 New판. 《Nature's Building Blocks: An A–Z Guide to the Elements》. Oxford: Oxford University Press. 634–651쪽. ISBN 978-0-19-960563-7.
- Fontani, Marco; Costa, Mariagrazia; Orna, Mary Virginia (2007). 《The Lost Elements: The Periodic Table's Shadow Side》. Oxford: Oxford University Press. 508쪽. ISBN 978-0-19-938334-4.
- Mazurs, E. G. (1974). 《Graphic Representations of the Periodic System During One Hundred Years》. Alabama: University of Alabama Press. ISBN 978-0-19-960563-7.
- Rouvray, D.H.; King, R. B. 편집 (2004). 《The Periodic Table: Into the 21st Century》. 제2회 국제 주기율표 학회, 1부, 캐나나스키스 게스트 랜치, 앨버타, 2003년 7월 14-20일. Baldock, Hertfordshire: Research Studies Press. ISBN 978-0-86380-292-8.
- Rouvray, D.H.; King, R. B. 편집 (2006). 《The Mathematics of the Periodic Table》. 제2회 국제 주기율표 학회, 2부, 캐나나스키스 게스트 랜치, 앨버타, 2003년 7월 14-20일. New York: Nova Science. ISBN 978-1-59454-259-6.
- Scerri, E (n.d.). “Books on the Elements and the Periodic Table” (PDF). 2020년 8월 11일에 원본 문서 (PDF)에서 보존된 문서. 2018년 7월 9일에 확인함.
- Scerri, E.; Restrepo, G 편집 (2018). 《Mendeleev to Oganesson: A Multidisciplinary Perspective on the Periodic Table》. 제3회 국제 주기율표 학회, 쿠스코, 페루 2012년 8월 14-16일. Oxford: Oxford University Press. ISBN 978-0-86380-292-8.
- van Spronsen, J. W. (1969). 《The Periodic System of Chemical Elements: A History of the First Hundred Years》. Amsterdam: Elsevier. ISBN 978-0-444-40776-4.
- Verde, M. 편집 (1971). 《Atti del convegno Mendeleeviano: Periodicità e simmetrie nella struttura elementare della materia》 [멘델레예프 학회 회의록: 물질의 기본 구조에서 주기성과 대칭성]. 제1회 국제 주기율표 학회, 토리노-로마, 1969년 9월 15-21일. 토리노: Accademia delle Scienze di Torino.
외부 링크
[편집]- 대한화학회 웹사이트의 주기율표
- 주기율표 과학 역사 연구소 디지털 컬렉션의 주요 주제 페이지로, 원형, 원통형, 피라미드형, 나선형, 삼각형 형태 등 다양한 주기율표의 시각적 표현을 선별하여 다룬다.
- IUPAC 주기율표
- 동적 주기율표, 대화형 레이아웃 포함
- 에릭 스체리, 주기율표의 역사 및 철학 전문 선도 과학 철학자
- 주기율표의 인터넷 데이터베이스
- 멸종 위기 원소 주기율표
- 샘플 주기율표
- 주기적 동영상 보관됨 3 7월 2023 - 웨이백 머신
- 웹엘리먼츠
- 원소 주기적 그래픽 보관됨 30 12월 2022 - 웨이백 머신


















