컬럼 크로마토그래피

화학에서 컬럼 크로마토그래피(Column chromatography)는 혼합물에서 단일 화합물을 분리하는 데 사용되는 크로마토그래피 방법이다. 크로마토그래피는 흡착제에 대한 화합물의 차등 흡수에 따라 물질을 분리할 수 있다. 화합물은 서로 다른 속도로 컬럼을 통과하여 분획으로 분리될 수 있다. 이 기술은 다양한 흡착제(정상상, 역상 등)와 다양한 용매를 사용할 수 있으므로 광범위하게 적용 가능하다. 이 기술은 마이크로그램부터 킬로그램까지 다양한 스케일에서 사용할 수 있다. 컬럼 크로마토그래피의 주요 장점은 공정에서 사용되는 정지상의 상대적으로 저렴한 비용과 일회용성이다. 후자는 재활용으로 인한 교차 오염 및 정지상 열화를 방지한다. 컬럼 크로마토그래피는 중력을 이용하여 용매를 이동시키거나 압축 가스를 이용하여 용매를 컬럼을 통해 밀어낼 수 있다.
박층 크로마토그래피는 혼합물이 컬럼 크로마토그래피로 정제될 때 화합물 혼합물이 어떻게 거동할지 보여줄 수 있다. 컬럼 크로마토그래피를 수행하기 전에 박층 크로마토그래피를 사용하여 분리를 먼저 최적화한다.
컬럼 준비
[편집]컬럼은 고체 흡착제를 원통형 유리 또는 플라스틱 튜브에 채워 준비한다. 크기는 분리할 화합물의 양에 따라 달라진다. 튜브 바닥에는 고체상을 제자리에 고정하기 위한 면 또는 유리솜 마개 또는 유리 소결 필터가 포함되어 있다. 컬럼 상단에는 용매 저장소가 부착될 수 있다.
컬럼을 준비하는 데는 건식 방법과 습식 방법의 두 가지 방법이 일반적으로 사용된다. 건식 방법의 경우, 컬럼은 먼저 건식 정지상 분말로 채워진 후 이동상을 첨가하여 컬럼이 완전히 젖을 때까지 컬럼을 통해 흘려보내고, 이 시점부터는 절대 마르지 않도록 한다.[1] 습식 방법의 경우, 용리액과 정지상 분말의 슬러리를 준비한 후 컬럼에 조심스럽게 붓는다. 실리카의 상단은 평평해야 하며, 실리카의 상단은 모래층으로 보호할 수 있다. 유기 물질을 진행시키기 위해 용리액을 컬럼을 통해 천천히 통과시킨다.
개별 구성 요소는 정지상에 의해 다르게 보유되며 용리액과 함께 컬럼을 통해 다른 속도로 이동하는 동안 서로 분리된다. 컬럼 끝에서 하나씩 용출된다. 전체 크로마토그래피 과정 동안 용리액은 일련의 분획으로 수집된다. 분획은 분획 수집기를 사용하여 자동으로 수집할 수 있다. 크로마토그래피의 생산성은 한 번에 여러 컬럼을 실행하여 증가시킬 수 있다. 이 경우 다중 스트림 수집기가 사용된다. 용리액 흐름의 조성을 모니터링하고 각 분획은 용해된 화합물에 대해 분석된다. 예를 들어 분석 크로마토그래피, 자외선 가시광선 분광법, 또는 형광 분광법에 의해 분석된다. 유색 화합물(또는 UV 램프를 사용한 형광 화합물)은 유리벽을 통해 움직이는 띠로 볼 수 있다.
정지상
[편집]
컬럼 크로마토그래피의 정지상 또는 흡착제는 고체이다. 컬럼 크로마토그래피에 가장 일반적인 정지상은 실리카 젤이며, 다음으로 가장 일반적인 것은 산화 알루미늄이다. 과거에는 셀룰로스 분말이 자주 사용되었다. 이온 교환 크로마토그래피, 역상 크로마토그래피(RP), 친화성 크로마토그래피 또는 확장층 흡착(EBA)을 수행하기 위해 다양한 정지상을 사용할 수 있다. 정지상은 일반적으로 미세하게 분쇄된 분말 또는 젤 및 표면적을 증가시키기 위해 미세 다공성이지만, EBA에서는 유동층이 사용된다. 정지상 무게와 컬럼에 적용할 수 있는 분석물 혼합물의 건조 무게 사이에 중요한 비율이 있다. 실리카 컬럼 크로마토그래피의 경우, 이 비율은 분석물 성분이 얼마나 가까이 용출되는지에 따라 20:1에서 100:1 사이에 있다.[2]
이동상 (용리액)
[편집]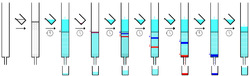
이동상 또는 용리액은 화합물을 컬럼을 통해 이동시키는 데 사용되는 용매 또는 용매 혼합물이다. 크로마토그래피를 실행하는 데 필요한 시간과 용리액의 양을 최소화하기 위해 관심 화합물의 머무름 인자 값이 대략 0.2 - 0.3이 되도록 선택된다. 용리액은 또한 서로 다른 화합물을 효과적으로 분리할 수 있도록 선택된다. 용매 시스템이 발견될 때까지 다른 극성의 용매를 사용하여 종종 동일한 정지상을 가진 박층 크로마토그래피(TLC)를 사용하여 소규모 사전 테스트에서 용리액을 최적화한다. 극성이 증가하는 순서로 일반적인 이동상 용매에는 헥세인, 다이클로로메테인, 아세트산 에틸, 아세톤, 및 메탄올이 포함된다.[3] 일반적인 용매 시스템은 헥세인과 아세트산 에틸의 혼합물이며, 표적 화합물의 머무름 인자가 0.2 - 0.3이 될 때까지 비율을 조정한다. 일반적인 오해와 달리, 메탄올 단독으로 고극성 화합물에 대한 용리액으로 사용될 수 있으며, 실리카 젤을 용해시키지 않는다.
각 특정 분리에 대한 최적의 부피 유량이 있다. 용리액의 유속이 빠르면 컬럼을 실행하는 데 필요한 시간이 최소화되어 확산이 최소화되고 결과적으로 더 나은 분리가 이루어진다. 그러나 최대 유속은 분석물이 정지상과 이동상 사이에서 평형에 도달하는 데 유한한 시간이 필요하기 때문에 제한된다. 반 덤터 방정식을 참조하라. 간단한 실험실 컬럼은 중력 흐름에 의해 작동한다. 이러한 컬럼의 유속은 신선한 용리액으로 채워진 컬럼을 정지상 상단 위로 확장하여 증가시키거나 탭 제어기로 감소시킬 수 있다. 펌프를 사용하거나 압축 가스(예: 공기, 질소, 또는 아르곤)를 사용하여 용매를 컬럼을 통해 밀어내어 더 빠른 유속을 얻을 수 있다(플래시 컬럼 크로마토그래피).[4][5]

플래시 컬럼 크로마토그래피의 정지상 입자 크기는 중력 컬럼 크로마토그래피보다 일반적으로 더 미세하다. 예를 들어, 전자의 기술에서 가장 널리 사용되는 실리카 젤 등급 중 하나는 메쉬 230 – 400 (40 – 63 μm)인 반면, 후자의 기술은 일반적으로 메쉬 70 – 230 (63 – 200 μm) 실리카 젤을 필요로 한다.[6]
플래시 컬럼의 성공적인 개발을 지원하는 스프레드시트가 개발되었다. 이 스프레드시트는 분석물의 머무름 부피 및 밴드 부피, 각 분석물을 포함할 것으로 예상되는 분획 번호, 그리고 인접한 피크 간의 해상도를 추정한다. 이 정보는 사용자가 플래시 컬럼 자체를 시도하기 전에 준비 규모 분리에 대한 최적의 매개변수를 선택할 수 있도록 한다.[7]
자동화 시스템
[편집]
컬럼 크로마토그래피는 모든 실험실에서 극도로 시간이 많이 소요되는 단계이며, 어떤 공정 실험실에서도 빠르게 병목 현상이 될 수 있다. 바이오태지, 부키, 인터심, 테레다인 이스코와 같은 많은 제조업체는 자동 플래시 크로마토그래피 시스템(일반적으로 LPLC, 저압 액체 크로마토그래피라고 불림, 350–525 kPa or 50.8–76.1 psi 주변)을 개발하여 정제 공정에서 사람의 개입을 최소화한다. 자동화 시스템에는 기울기 펌프, 샘플 주입 포트, UV 검출기, 용리액을 수집하는 분획 수집기와 같이 일반적으로 더 비싼 고성능 액체 크로마토그래피(HPLC) 시스템에서 발견되는 구성 요소가 포함된다. 일반적으로 이러한 자동화 시스템은 몇 밀리그램에서 산업 규모의 수 킬로그램까지 샘플을 분리할 수 있으며 준비용 HPLC 시스템에서 여러 번 주입하는 것보다 훨씬 저렴하고 빠른 솔루션을 제공한다.
LPLC 시스템의 해상도(또는 혼합물을 분리하는 능력)는 HPLC에 비해 항상 낮을 것이다. 이는 HPLC 컬럼의 충전재가 훨씬 작을 수 있기 때문이며, 일반적으로 5 마이크로미터에 불과하여 정지상의 표면적을 증가시키고 표면 상호작용을 증가시켜 더 나은 분리를 제공한다. 그러나 이러한 작은 충전 매체를 사용하면 높은 배압이 발생하며, 이것이 고압 액체 크로마토그래피라고 불리는 이유이다. LPLC 컬럼은 일반적으로 약 50 마이크로미터의 실리카로 충전되어 배압과 해상도를 감소시키지만, 고가의 고압 펌프의 필요성도 제거한다. 제조업체는 현재 더 높은 압력의 플래시 크로마토그래피 시스템으로 전환하기 시작했으며, 이를 중압 액체 크로마토그래피(MPLC) 시스템이라고 부르며 1 MPa (150 psi) 이상에서 작동한다.
컬럼 크로마토그램 해상도 계산
[편집]
일반적으로 컬럼 크로마토그래피는 연동 펌프를 사용하여 컬럼 상단을 통해 버퍼와 용액 샘플을 흐르게 한다. 용액과 버퍼는 컬럼을 통과하며, 컬럼 설치 끝에 있는 분획 수집기가 용출된 샘플을 수집한다. 분획 수집 전에 컬럼에서 용출된 샘플은 분광광도계 또는 질량 분석기와 같은 검출기를 통과하여 용액 혼합물에 분리된 샘플의 농도를 결정할 수 있다.
예를 들어, 용액 샘플에서 컬럼에 대한 결합 능력이 다른 두 가지 다른 단백질을 분리하려면 280 nm 파장을 사용하는 분광광도계가 좋은 검출기 유형이 될 것이다. 컬럼을 통해 용출된 용액을 통과하는 단백질 농도가 높을수록 해당 파장의 흡수도가 높아진다.
컬럼 크로마토그래피는 다양한 농도로 검출기를 통과하는 용출된 용액의 일정한 흐름을 가지므로, 검출기는 시간에 걸쳐 용출된 샘플의 농도를 플롯해야 한다. 샘플 농도 대 시간의 이 플롯을 크로마토그램이라고 한다.
크로마토그래피의 궁극적인 목표는 용액 혼합물에서 다른 구성 요소를 분리하는 것이다. 해상도는 혼합물에서 구성 요소 간의 분리 정도를 나타낸다. 크로마토그램의 해상도가 높을수록 컬럼이 제공하는 샘플 분리 정도가 더 좋다. 이 데이터는 특정 샘플에 대한 컬럼의 분리 특성을 결정하는 좋은 방법이다. 해상도는 크로마토그램에서 계산할 수 있다.
위 그림의 별도 곡선은 컬럼 수지에 대한 친화도에 따라 시간이 지남에 따른 다른 샘플 용출 농도 프로파일을 나타낸다. 해상도를 계산하려면 머무름 시간과 곡선 너비가 필요하다.
머무름 시간은 검출기에 의한 신호 감지 시작부터 각기 다른 샘플의 용출 농도 프로파일의 피크 높이까지의 시간이다.
곡선 너비는 크로마토그램에서 다른 샘플의 농도 프로파일 곡선의 너비이며 시간 단위로 표시된다.
크로마토그램 해상도를 계산하는 간단한 방법은 플레이트 모델을 사용하는 것이다.[8] 플레이트 모델은 컬럼이 특정 개수의 섹션 또는 플레이트로 나눌 수 있다고 가정하며 각 개별 플레이트에 대한 질량 균형을 계산할 수 있다. 이 접근 방식은 일반적인 크로마토그램 곡선을 가우스 분포 곡선으로 근사한다. 이를 통해 곡선 너비는 곡선의 표준 편차의 4배인 4σ로 추정된다. 머무름 시간은 신호 감지 시작부터 가우스 곡선의 피크 높이까지의 시간이다.
위 그림의 변수에서 컬럼 플레이트 모델의 해상도, 플레이트 번호 및 플레이트 높이는 다음 방정식을 사용하여 계산할 수 있다.
해상도 (Rs):
- Rs = 2(tRB – tRA)/(wB + wA),
여기서:
- tRB = 용질 B의 머무름 시간
- tRA = 용질 A의 머무름 시간
- wB = 용질 B의 가우스 곡선 너비
- wA = 용질 A의 가우스 곡선 너비
플레이트 번호 (N):
- N = (tR)2/(w/4)2
플레이트 높이 (H):
- H = L/N
여기서 L은 컬럼의 길이이다.[8]
컬럼 흡착 평형
[편집]흡착 컬럼의 경우 컬럼 수지(정지상)는 미세구슬로 구성된다. 단백질, 탄수화물, 금속 이온 또는 기타 화학 화합물과 같은 더 작은 입자는 미세구슬에 결합된다. 미세구슬에 부착된 각 결합 입자는 정제 또는 분리해야 하는 컬럼을 통해 보내지는 용질 샘플과 1:1 비율로 결합한다고 가정할 수 있다.
분리될 표적 분자와 컬럼 비드의 결합 분자 간의 결합은 간단한 평형 반응 Keq = [CS]/([C][S])로 모델링할 수 있다. 여기서 Keq는 평형 상수이고, [C]와 [S]는 각각 표적 분자와 컬럼 수지에 있는 결합 분자의 농도이다. [CS]는 컬럼 수지에 결합된 표적 분자 복합체의 농도이다.[8]
이를 바탕으로 세 가지 다른 등온선이 컬럼 크로마토그래피의 결합 역학을 설명하는 데 사용될 수 있다: 선형, 랭뮤어, 프룬들리히.
선형 등온선은 정제해야 하는 용질 농도가 결합 분자에 비해 매우 작을 때 발생한다. 따라서 평형은 다음과 같이 정의할 수 있다.
- [CS] = Keq[C].
산업적 규모 사용의 경우, 컬럼 수지 비드의 총 결합 분자가 계산에 포함되어야 한다. 왜냐하면 비어 있는 위치를 고려해야 하기 때문이다. 랭뮤어 등온선과 프룬들리히 등온선은 이러한 평형을 설명하는 데 유용하다. 랭뮤어 등온선은 다음과 같다.
- [CS] = (KeqStot[C])/(1 + Keq[C]), 여기서 Stot는 비드의 총 결합 분자이다.
프룬들리히 등온선은 다음과 같다.
- [CS] = Keq[C]1/n
프룬들리히 등온선은 정제해야 하는 용액의 많은 다른 샘플에 컬럼이 결합할 수 있을 때 사용된다. 많은 다른 샘플이 비드에 대한 다른 결합 상수를 가지므로 많은 다른 Keq가 있다. 따라서 랭뮤어 등온선은 이 경우 결합에 대한 좋은 모델이 아니다.[8]
같이 보기
[편집]- 고속 단백질 액체 크로마토그래피 (FPLC) – 컬럼 크로마토그래피를 사용한 단백질 분리
- 고성능 액체 크로마토그래피 (HPLC) – 고압을 사용한 컬럼 크로마토그래피
각주
[편집]- ↑ Shusterman, AJ; McDougal, PG; Glasfeld, A (1997). 《Dry-Column Flash Chromatography》. 《J Chem Educ》 74. 1222쪽. Bibcode:1997JChEd..74.1222S. doi:10.1021/ed074p1222. ISSN 0021-9584.
- ↑ “How to set-up a flash chromatography silica column and actually succeed at separation”. 《reachdevices.com》. REACH Devices, LLC. 2019년 1월 3일에 확인함.
- ↑ Furniss, Brian S.; Hannaford, Antony, J.; Smith, Peter W. G.; Tatchell, Austin S. (1989). 《Vogel's Textbook of Practical Organic Chemistry》. Longman Scientific & Technical. 203쪽. ISBN 978-0582462366.
- ↑ Still, WC; Kahn, M; Mitra, A (1978). 《Rapid chromatographic technique for preparative separations with moderate resolution》. 《J Org Chem》 43 (ACS). 2923–2925쪽. doi:10.1021/jo00408a041.
- ↑ Harwood, Laurence M.; Moody, Christopher J. (1989년 6월 13일). 《Experimental organic chemistry: Principles and Practice》 Illurat판. London: Blackwell. 180–185쪽. ISBN 978-0-632-02017-1. OCLC 1079261960.
- ↑ “Material Harvest Silica Gel for Normal Phase Column Chromatography”. Material Harvest. 2008. 2019년 1월 3일에 확인함.
- ↑ Fair, JD; Kormos, CM (2008). 《Flash column chromatograms estimated from thin-layer chromatography data》. 《J Chromatogr A》 1211. 49–54쪽. doi:10.1016/j.chroma.2008.09.085. ISSN 0021-9673. PMID 18849041.
- ↑ 가 나 다 라 Harrison, Roger G; Todd, Paul W.; Rudge, Scott R.; Petrides, Demetri P. (2003). 《Bioseparations science and engineering》 2판. New York, NY: 옥스퍼드 대학교 출판부. ISBN 9780190213732. OCLC 899240244.
