美法侖
 | |
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Alkeran、Evomela、Phelinun及其他 |
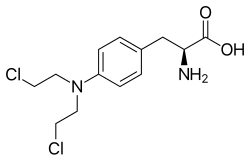
| 其他名稱 | (2S)-2-amino-3-{4-[bis(2-chloroethyl)amino]phenyl}propanoic acid |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a682220 |
| 核准狀況 | |
| 给药途径 | 口服給藥, 靜脈注射, 直接注射或輸注到動脈 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 | |
| 藥物動力學數據 | |
| 生物利用度 | 25–89% (口服) |
| 药物代谢 | 水解為不具活性的代謝物 |
| 生物半衰期 | 1.5 ± 0.8小時 |
| 排泄途徑 | 腎臟 (靜脈注射: 5.8–21.3%) |
| 识别信息 | |
| |
| CAS号 | 148-82-3 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.005.207 |
| 化学信息 | |
| 化学式 | C13H18Cl2N2O2 |
| 摩尔质量 | 305.20 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
美法侖(INN:melphalan),以商品名稱Alkeran等於市面上銷售,是一種化療藥物,用於治療多發性骨髓瘤、惡性淋巴瘤、淋巴細胞性白血病和骨髓細胞性白血病、兒童神經母細胞瘤、卵巢癌、乳腺腺癌以及葡萄膜黑色素瘤。[2][3][5][6]
給藥途徑有口服、靜脈注射[6]或是直接注射或輸注到動脈中。[7]
使用後常見的副作用有噁心和骨髓抑制[6]。其他可能的嚴重副作用有過敏性休克和罹患其他癌症[6]。個體於懷孕期間使用可能對胎兒造成傷害。[8]美法侖屬於氮芥類烷化劑。[6]它透過干擾癌細胞的DNA和RNA的合成來發揮作用。[6]
美法侖於1964年在美國獲准用於醫療用途。[6]於1996年獲准在歐盟用於醫療用途。[5]此藥物已列於世界衛生組織基本藥物標準清單中,[9]市面上有其學名藥(通用名藥物)販售。[10]
醫療用途
[编辑]美法侖在歐盟適用於治療多發性骨髓瘤、惡性淋巴瘤(霍奇金氏淋巴瘤、非霍奇金淋巴瘤)、急性淋巴細胞性白血病和骨髓細胞性白血病、兒童神經母細胞瘤、卵巢癌以及乳腺腺癌。[5]
美法侖在美國被用作多發性骨髓瘤患者進行造血幹細胞移植前的高劑量預處理。[3][11]在歐盟,它與其他細胞毒性藥物聯合使用,作為患有惡性血液疾病的成年人進行異體造血幹細胞移植(捐贈者與受贈者基因不完全相同)前的減輕強度預處理。[5]
美國食品藥物管理局(FDA)於2023年8月批准美法侖(商品名Hepzato)作為一種肝臟導向療法,用於治療以下葡萄膜黑色素瘤成年患者:[12]
副作用
[编辑]使用後常見副作用有:[6]
較不常見的副作用有:
作用機制
[编辑]美法侖透過烷化作用,改變DNA核苷酸中的鳥嘌呤,並導致DNA鏈之間產生連結。這種化學改變會抑制DNA和RNA的合成,而這些功能對於細胞存活極為重要。這些變化會對分裂中和非分裂中的腫瘤細胞產生細胞毒性。[13]
合成
[编辑]4-硝基-L-苯丙氨酸 (1) 經與鄰苯二甲酸酐加熱,轉化為其鄰苯二甲醯亞胺,再轉化為其乙酯 (2)。催化氫化產生相應的苯胺。於酸性條件下與環氧乙烷加熱,隨後經三氯氧磷處理得到雙氯化物,最後通過在鹽酸中加熱去除保護基團,即得美法侖 (3)。
社會與文化
[编辑]法律地位
[编辑]歐洲藥品管理局(EMA)的人用醫藥產品委員會(CHMP)於2020年9月17日採納一項正面意見,建議授予產品名稱為Phelinun的美法侖混合藥的上市許可。[14]申請藥商為Adienne S.r.l. S.U.。[14]Phelinun於2020年11月在歐盟獲准用於成人及兒童血液惡性疾病患者,在進行異體造血幹細胞移植前的減輕強度預處理。[5]
參考文獻
[编辑]- ^ Prescription medicines: registration of new generic medicines and biosimilar medicines, 2017. Therapeutic Goods Administration (TGA). 2022-06-21 [2024-03-30]. (原始内容存档于2023-07-06).
- ^ 2.0 2.1 Alkeran- melphalan tablet, film coated. DailyMed. 2019-11-18 [2022-04-23]. (原始内容存档于2023-09-08).
- ^ 3.0 3.1 3.2 Evomela- melphalan injection, powder, lyophilized, for solution. DailyMed. 2021-12-31 [2022-04-23]. (原始内容存档于2025-02-09).
- ^ fda.gov [裸網址]
- ^ 5.0 5.1 5.2 5.3 5.4 5.5 Phelinun EPAR. European Medicines Agency (EMA). 2020-09-15 [2022-04-23]. (原始内容存档于2025-06-22). Text was copied from this source which is copyright European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 6.7 6.8 Melphalan Monograph for Professionals. Drugs.com. American Society of Health-System Pharmacists. [2019-10-09]. (原始内容存档于2019-08-17).
- ^ Thampi, Sheila; Hetts, Steven W. Superselective intra-arterial melphalan therapy for newly diagnosed and refractory retinoblastoma: results from a single institution. Clinical Ophthalmology (Auckland, N.Z.). 2013-05-27: 7:981–989 [2025-06-29]. doi:10.2147/OPTH.S43398. (原始内容存档于2025-03-18).
- ^ Melphalan Use During Pregnancy. Drugs.com. [2019-10-09]. (原始内容存档于2019-10-09).
- ^ World Health Organization. World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. hdl:10665/325771
 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ British national formulary : BNF 76 76. Pharmaceutical Press. 2018: 873–874. ISBN 9780857113382.
- ^ Evomela (Captisol-enabled melphalan HCl) for Injection. U.S. Food and Drug Administration (FDA). 2016-11-30 [2023-09-07].[失效連結]
- ^ Oncology (Cancer) / Hematologic Malignancies Approval Notifications. U.S. Food and Drug Administration (FDA). 2023-08-14 [2023-09-07].[失效連結]
 本文含有此來源中屬於公有领域的内容。
本文含有此來源中屬於公有领域的内容。
- ^ Melphalan. National Cancer Institute. [2014-08-04]. (原始内容存档于2014-08-08).
- ^ 14.0 14.1 Phelinun: Pending EC decision. European Medicines Agency (EMA). 2020-09-18 [2020-09-21]. (原始内容存档于2020-09-23). Text was copied from this source which is copyright European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
