탄소-수소 결합
화학에서 탄소–수소 결합(영어: Carbon–hydrogen bond, C−H 결합)은 많은 유기 화합물에서 발견될 수 있는 탄소와 수소 원자 사이의 화학 결합이다.[1] 이 결합은 공유, 단일 결합을 의미하며, 탄소가 최대 4개의 수소와 외부 원자가 전자를 공유한다. 이는 두 원자 모두의 외부 껍질을 완성하여 안정하게 만든다.[2]
탄소-수소 결합은 약 1.09 Å (1.09 × 10−10 m)의 결합 길이와 약 413 kJ/mol의 결합 에너지를 가진다 (아래 표 참조). 폴링 척도—C (2.55)와 H (2.2)를 사용하면 이 두 원자 사이의 전기 음성도 차이는 0.35이다. 이 작은 전기 음성도 차이 때문에 C−H 결합은 일반적으로 비극성으로 간주된다. 분자의 구조식에서 수소 원자는 종종 생략된다. C−H 결합과 C−C 결합으로만 구성된 화합물 부류는 알케인, 알켄, 알카인 및 방향족 탄화수소이다. 이들을 총칭하여 탄화수소라고 한다.
2016년 10월, 천문학자들은 생명의 매우 기본적인 화학 성분—탄소-수소 분자 (CH, 또는 메틸리다인 라디칼), 양이온 탄소-수소 이온 (CH+
) 및 탄소 이온 (C+
)—이 이전에 생각했던 것처럼 초신성 및 젊은 항성과 관련된 난류 사건과 같은 다른 방식이 아니라 주변 항성의 자외선 에너지로 상당 부분 생성된다고 보고했다.[3]
결합 길이
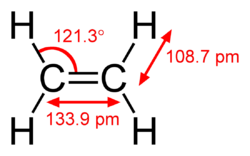
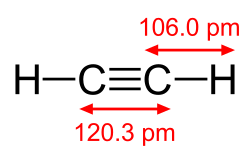
[편집]탄소-수소 결합의 길이는 탄소 원자의 혼성화에 따라 약간 달라진다. 수소 원자와 sp2 혼성화 탄소 원자 사이의 결합은 수소와 sp3 혼성화 탄소 사이의 결합보다 약 0.6% 더 짧다. 수소와 sp 혼성화 탄소 사이의 결합은 sp3 C–H보다 약 3% 더 짧다. 이러한 경향은 에테인, 에틸렌 및 아세틸렌의 분자기하에 의해 설명된다.
| 분자 | 메테인 | 에테인 | 에틸렌 | 아세틸렌 |
|---|---|---|---|---|
| 화학식 | CH4 | C2H6 | C2H4 | C2H2 |
| 종류 | 알케인 | 알케인 | 알켄 | 알카인 |
| 구조 | 
|

|
|
|
| 탄소의 혼성화 | sp3 | sp3 | sp2 | sp |
| C–H 결합 길이 | 1.087 Å | 1.094 Å | 1.087 Å | 1.060 Å |
| 에테인 C–H 결합 길이 비율 | 99% | 100% | 99% | 97% |
| 구조 결정 방법 | 마이크로파 분광법 | 마이크로파 분광법 | 마이크로파 분광법 | 적외선 분광법 |
반응
[편집]일반적으로 C−H 결합은 매우 강해서 비교적 반응성이 낮다. 총칭하여 탄소산이라고 불리는 여러 화합물 부류에서는 C−H 결합이 양성자 제거에 충분히 산성일 수 있다. 비활성화된 C−H 결합은 알케인에서 발견되며 헤테로원자 (O, N, Si 등)에 인접해 있지 않다. 이러한 결합은 일반적으로 유리기 치환 반응에만 참여한다. 그러나 많은 효소가 이러한 반응을 일으키는 것으로 알려져 있다.[5]
C−H 결합은 가장 강한 결합 중 하나이지만, 헤테로원자가 없는 상당히 안정한 유기 화합물의 경우에도 그 크기가 30% 이상 달라진다.[6][7]
| 결합 | 탄화수소 라디칼 | 몰 결합 해리 에너지 (kcal) | 몰 결합 해리 에너지 (kJ) |
|---|---|---|---|
| CH3−H | 메틸 | 104 | 440 |
| C2H5−H | 에틸 | 98 | 410 |
| (CH3)2HC−H | 아이소프로필 | 95 | 400 |
| (CH3)3C−H | tert-부틸 | 93 | 390 |
| CH2=CH−H | 바이닐 | 112 | 470 |
| HC≡C−H | 에티닐 | 133 | 560 |
| C6H5−H | 페닐 | 110 | 460 |
| CH2=CHCH2−H | 알릴 | 88 | 370 |
| C6H5CH2−H | 벤질 | 85 | 360 |
| OC4H7−H | 테트라하이드로퓨라닐 | 92 | 380 |
| CH3C(O)CH2−H | 아세토닐 | 96 | 400 |
같이 보기
[편집]각주
[편집]- ↑ March, Jerry (1985), 《Advanced Organic Chemistry: Reactions, Mechanisms, and Structure》 3판, New York: Wiley, ISBN 0-471-85472-7
- ↑ “Life Sciences Cyberbridge”. 《Covalent Bonds》. 2015년 9월 18일에 원본 문서에서 보존된 문서. 2015년 9월 15일에 확인함.
- ↑ Landau, Elizabeth (2016년 10월 12일). “Building Blocks of Life's Building Blocks Come From Starlight”. 《미국 항공 우주국》. 2016년 10월 13일에 확인함.
- ↑ CRC Handbook of Chemistry and Physics, 88th edition
- ↑ Bollinger, J. M. Jr., Broderick, J. B. "Frontiers in enzymatic C-H-bond activation" Current Opinion in Chemical Biology 2009, vol. 13, page 51-7. doi:10.1016/j.cbpa.2009.03.018
- ↑ “Bond Energies”. Organic Chemistry, Michigan State University. 2016년 8월 29일에 원본 문서에서 보존된 문서.
- ↑ Yu-Ran Luo and Jin-Pei Cheng "Bond Dissociation Energies" in CRC Handbook of Chemistry and Physics, 96th Edition
